临川市2019年高二化学下学期月考测验完整试卷
| 1. 选择题 | 详细信息 |
|
下列化学用语表示不正确的是( ) A. S2-的结构示意图:  B. 乙烯的比例模型: B. 乙烯的比例模型:C. 乙醛的结构简式:CH3COH D. 含中子数为10的氧元素的一种核素 |
|
| 2. 选择题 | 详细信息 |
|
在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。在一定条件下的以下反应中,最符合绿色化学概念的是( ) A. 用水吸收二氧化氮得到硝酸 B. 铝盐溶液与氨水反应制氢氧化铝 C. 苯与液溴反应制溴苯 D. 乙烯与氯化氢反应制备氯乙烷 |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是(NA表示阿伏加德罗常数的值)( ) A. 1mol甲基含10NA个电子 B. 标准状况下,11.2 L三氯甲烷所含的分子数目为0.5NA C. 一定条件下,2.6 g苯和苯乙烯的混合物完全燃烧消耗O2的分子数为0.25NA D. 15 g C2H6中含有共价键数目为3NA |
|
| 4. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 质谱、红外光谱都能够快速、精确地测定有机物的相对分子质量 B. 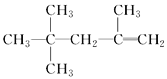 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯C. 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 D. 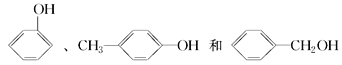 互为同系物 互为同系物 |
|
| 5. 选择题 | 详细信息 |
|
工业上可由乙苯生产苯乙烯: A. 乙苯和苯乙烯均能发生取代反应、加聚反应和氧化反应 B. 用溴水可以区分苯乙烯和乙苯 C. 1 mol苯乙烯最多可与4 mol氢气加成,加成产物的一氯代物共有5种 D. 乙苯和苯乙烯分子中共平面的碳原子数最多都为7 |
|
| 6. 选择题 | 详细信息 |
白藜芦醇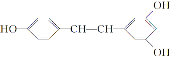 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( ) 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )A. 白藜芦醇属于三元醇,能与Na反应产生H2 B. 能与NaOH反应,1 mol 该化合物最多能消耗NaOH 3 mol C. 能使FeCl3溶液显色 D. 能与浓溴水反应,1 mol 该化合物最多能消耗溴6 mol |
|
| 7. 选择题 | 详细信息 |
|
一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池。有关该电池的叙述错误的是( ) A. 当外电路通过1.2mol电子时,理论上消耗甲醇6.4g B. 甲醇在负极发生氧化反应 C. 正极电极反应为:O2+2H2O+4e-=== 4OH- D. 放电时电解质溶液的pH增大 |
|
| 8. 选择题 | 详细信息 |
|
已知:乙醇可被强氧化剂直接氧化为乙酸, A. 加成反应 B. 水解反应 C. 氧化反应 D. 消去反应 |
|
| 9. 选择题 | 详细信息 |
双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示: )是一种重要的化工原料,它的一种合成路线如下图所示:丙烯 下列说法正确的是( ) A. 1 mol 双酚A最多可与2 mol Br2反应 B. G物质是乙醛的同系物 C. E物质的名称是1-溴丙烷 D. 反应③的化学方程式是 |
|
| 10. 选择题 | 详细信息 |
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式为 (未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( ) (未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )A. H2 B. Br2的CCl4溶液 C. HBr D. Ag(NH3)2OH溶液 |
|
| 11. 选择题 | 详细信息 |
|
将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( ) A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3 B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH |
|
| 12. 选择题 | 详细信息 |
|
将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得沉淀20g ,滤液质量比原石灰水减少5.8g,该有机物不可能是( ) A. 乙烯 B. 乙醇 C. 乙烷 D. 乙二醇 |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
下列操作可以达到实验目的是
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
下列五种有机物:①甲烷 ②乙烯 ③乙炔 ④3甲基戊烷 ⑤甲苯,某同学在分类时将①④⑤划为一类,②③划为一类。将①④⑤划为一类的依据是( ) A. ①④⑤均为烃类物质 B. ①④⑤在光照下均能与Cl2发生取代反应 C. ①④⑤均不能发生加成反应 D. ①④⑤均不能使酸性高锰酸钾溶液褪色 |
|
| 15. 选择题 | 详细信息 |
镇咳药沐舒坦可由化合物甲和化合物乙在一定条件下制得: 下列有关叙述正确的是( ) A. 甲的分子式为C7H4NBr2Cl B. 沐舒坦分子中最多有13个碳原子共平面 C. 乙遇FeCl3溶液显紫色 D. 反应过程中加入适量K2CO3可提高沐舒坦的产率 |
|
| 16. 实验题 | 详细信息 | |||||||||||||||||||||||
为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内。
|
||||||||||||||||||||||||
| 17. 综合题 | 详细信息 | ||||||||||||||||||||
|
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化剂作用下,通过下列反应:CCl4+H2 (1)在密闭容器中,该反应达到平衡状态后,测得如下数据(假设不考虑副反应)。
|
|||||||||||||||||||||
| 18. 填空题 | 详细信息 |
|
按要求填空: (1)有机物A样品3.0g,对其进行如下操作:充分燃烧得3.36 L CO2(标准状况)和3.6 g H2O;质谱分析得A的相对分子质量为60,A的分子式为____________。A在催化剂Cu的作用下能被氧气氧化成C,C不能发生银镜反应,则A的名称是____________,C中官能团名称为____________。 (2) |
|
| 19. 实验题 | 详细信息 | |||||||||||||||||
|
2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。 已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。 (1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
|
||||||||||||||||||
| 20. 推断题 | 详细信息 |
某“化学鸡尾酒”通过模拟臭虫散发的聚集信息素可高效诱捕臭虫,其中一种组分T可通过下列反应路线合成(部分反应条件略)。 (1)A的化学名称是________,A→B新生成的官能团是________(写符号)。 (2) B→D的化学反应类型是________; D的核磁共振氢谱显示峰的组数为________。 (3)D→E的化学方程式为____________________________。 (4)G与新制的Cu(OH)2发生反应,所得有机物的结构简式为______________。 (5)L可由B与H2发生加成反应而得,已知R1CH2Br+NaC≡CR2―→R1CH2C≡CR2+NaBr,则M的结构简式为____________。 (6)已知R3C≡CR4 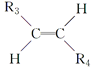 ,则T的结构简式为________。 ,则T的结构简式为________。 |
|





