2018至2019年高一下半期第二次调研考试化学题开卷有益(安徽省阜阳市第三中学)
| 1. 选择题 | 详细信息 |
|
2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表,下列推断不合理的是 A. 第35号元素的单质在常温常压下是液体 B. 位于第四周期第ⅤA族的元素为非金属元素 C. 第84号元素的最高化合价是+7 D. 第七周期0族元素的原子序数为118 |
|
| 2. 选择题 | 详细信息 |
|
阿伏加德罗常数的值为NA,下列说法正确的是( ) A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA B. 1mol Na2O2与足量潮湿的CO2充分反应,转移的电子数为2 NA C. 25℃1LpH=5的CO2溶液中,由水电离出的H+的数目为1×10-5NA D. 0.1 mol H2和0.1 molI2于密闭容器中充分反应后,容器内分子总数为0.2NA |
|
| 3. 选择题 | 详细信息 | ||||||||||
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
|
|||||||||||
| 4. 选择题 | 详细信息 |
|
下列结论正确的是( ) ①粒子半径:K+>Al3+>S2->Cl- ②氢化物的酸性:HCl>HBr>HI ③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te ⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si A. ①④⑤ B. ③⑥ C. ④⑤⑥ D. ②④⑤⑥ |
|
| 5. 选择题 | 详细信息 |
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )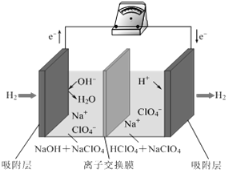 A. 放电时,两极电解质溶液的酸碱性均降低 B. 负极的电极反应是H2-2e-+2OH- ==== 2H2O C. 电池的总反应是2H2+O2 ==== 2H2O D. 电解质溶液中Na+向右移动,ClO |
|
| 6. 选择题 | 详细信息 |
将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。下列说法不正确的是( )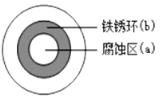 A. 铁片腐蚀过程发生的总化学方程式为:4Fe+6H2O+3O2 ==4 Fe(OH)3 B. 液滴之下氧气含量少, 铁片作负极,发生的还原反应为: Fe-2e-=Fe2+ C. 液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH- D. 铁片腐蚀最严重区域不是生锈最多的区域 |
|
| 7. 选择题 | 详细信息 |
2SO2(g)+O2(g)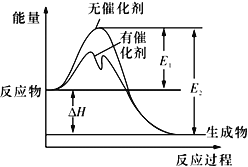 A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) C. 该反应中,反应物的总键能小于生成物的总键能 D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 |
|
| 8. 选择题 | 详细信息 | ||||||||||||
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)
|
|||||||||||||
| 9. 选择题 | 详细信息 |
|
下列事实中,不能用勒夏特列原理解释的是( ) A. 在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化 B. 开启啤酒瓶后,瓶中立刻泛起大量泡沫 C. 实验室中常用排饱和食盐水的方法收集Cl2 D. 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
|
| 10. 选择题 | 详细信息 |
|
在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变 ④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变 ⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零 ⑧单位时间内生成n mol D,同时生成2n mol A A. 4 B. 5 C. 6 D. 7 |
|
| 11. 选择题 | 详细信息 |
反应N2O4(g) A. a、c两点的反应速率:a>c B. a、c两点气体的颜色:a深,c浅 C. b、c两点的转化率:b>c D. 由b点到a点,可以用加热的方法 |
|
| 12. 选择题 | 详细信息 |
下列图示与对应的叙述相符的是( )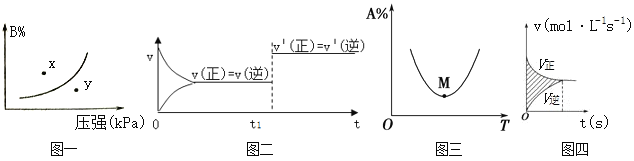 A. 图一表示反应:mA(s)+nB(g)⇌pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢. B. 图二是可逆反应:A(g)+B(s)⇌C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。 C. 图三表示对于化学反应mA(g)+nB(g) ⇌ pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。 D. 图四所示图中的阴影部分面积的含义是(v正-v逆) |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
下列实验操作、现象和所得到的结论均正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
下列关于能量判据和熵判据的说法中,不正确的是 A. 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 B. 放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的 C. 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 D. 由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程 |
|
| 15. 综合题 | 详细信息 |
|
在25℃时,用蒸馏水稀释1mol/L的醋酸溶液至0.01mol/L,随溶液的稀释,下列始终保持增大趋势的是( ) A. c(H+)×c(CH3COOH) B. c(CH3COO—)/c(H+) C. Kw/c(H+) D. c(CH3COOH)/c(CH3COO—) |
|
| 16. 选择题 | 详细信息 |
|
下列有关说法正确的是( ) A. 把0.05 mol NaOH固体加入到100 mL0.5 mol·L-1盐酸中,溶液导电能力几乎不变 B. 常温下,pH加和为12的弱酸与强碱混合,若成中性,则v(酸)>v(碱) C. 用碱式滴定管量取20.00mL酸性高锰酸钾溶液 D. 常温下,pH分别为2和4的盐酸等体积混合后,溶液pH=3 |
|
| 17. 选择题 | 详细信息 |
|
25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lg[D+],下列有关pD的叙述正确的是( ) ①中性D2O的pD=7 ②在1LD2O中,溶解0.01molNaOD,其pD值为12 ③1L0.01mol/L的DCl的重水溶液,pD=2 ④在100mL 0.25mol/L DCl的重水溶液中,加入50mL 0.2mol/L NaOD的重水溶液,反应后溶液的pD=1. A. ①② B. ③④ C. ②③ D. ②④ |
|
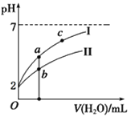
| 18. 选择题 | 详细信息 |
常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( ) A. 常温下,0.1 mol·L-1氨水中NH3·H2O的电离常数K约为1×10-5 B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) C. c点溶液中c(NH4+)=c(Cl-) D. d点代表两溶液恰好完全反应 |
|
| 19. 实验题 | 详细信息 |
|
某化学学习小组进行如下实验测定 H2C2O4·xH2O 中 x 值已知:M(H2C2O4)=90gmol-1 ① 称取1.260 g 纯草酸晶体,将草酸制成 100.00 mL 水溶液为待测液; ② 取25.00 mL 待测液放入锥形瓶中,再加入适量的稀 H2SO4; ③ 用浓度为 0.05 000 mol·L-1 的 KMnO4标准溶液进行滴定。 (1)请写出滴定中发生反应的离子方程式________________________。 (2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。 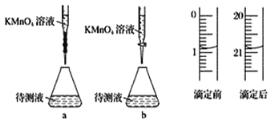 (3)由图可知消耗 KMnO4 溶液体积为________mL。 (4)滴定过程中眼睛应注视_______________,滴定终点锥形瓶内溶液的颜色变化为_______。 (5)通过上述数据,求得 x=_____。 a.若由于操作不当,滴定结束后滴定管尖嘴处有一气泡, 引起实验结果_____(填“偏大”、“偏小”或“无影响”); b.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果_______(填“偏大”、“偏小”或“无影响”); c.若在达到滴定终点时仰视读数,则所得结果________(填“偏大”、“偏小”或“无影响”); d.若其它操作均正确,滴定前未用标准 KMnO4 溶液润洗滴定管,引起实验结果_________(填“偏大”、“偏小”或“无影响”)。 |
|
| 20. 解答题 | 详细信息 |
如图是一个化学过程的示意图。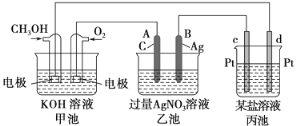 请回答: (1)甲池是________池,通入O2的一极电极反应式为__________________,该电池的总反应方程式为______________。 (2)乙池中A电极名称为________极,电极反应式为__________________。一段时间后溶液的pH________(填“增大”、“减小”或“不变”)。 (3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。 |
|
| 21. 综合题 | 详细信息 |
|
汽车尾气和燃煤尾气是造成空气污染的重要原因之一,治理汽车尾气和燃煤尾气是环境保护的重要课题。回答下列问题: (1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知: ①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol; ②N2(g)+2O2(g)= 2NO2(g) △H=+67.8 kJ/mol; ③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol 则CH4催化还原NO的热化学方程式为__________________________________。 (2)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) 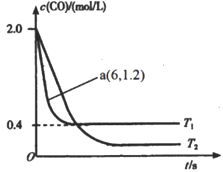 ①据此判断该反应的正反应为____(填“放热”或“吸热”)反应。 ②温度T1时,该反应的平衡常数K=_____;反应速率v=v正-v逆=k正c2(NO)c2(CO)-k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处 (3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素作还原剂,其基本流程如图:  ①SNCR-SCR脱硝技术中用NH3作还原剂还原NO的主要反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0,则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。 ②体系温度直接影响SNCR技术的脱硝效率,如图所示: 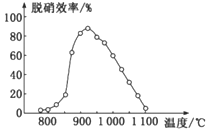 SNCR与SCR技术相比,SCR技术的反应温度不能太高,其原因是__________;当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是______________。 |
|
| 22. 综合题 | 详细信息 | ||||||||||
亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
|
|||||||||||