四川省广安市北京师范大学广安实验学校2020-2021年高二上学期12月考试化学免费试题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列有关说法不正确的是( ) A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性 B.84消毒液的主要成分是HClO C.新能源汽车的推广与使用有利于减少光化学烟雾的产生 D.利用肥皂水处理蚊虫叮咬,主要是利用肥皂水的弱碱性 |
|
| 2. 选择题 | 详细信息 |
|
下列属于强电解质的是 A.Al B.CH3OH C.CH3COOH D.BaSO4 |
|
| 3. 选择题 | 详细信息 |
|
准确量取25.00 mL酸性高锰酸钾溶液,可选用的仪器是( ) A.500 mL量筒 B.10 mL量筒 C.50 mL碱式滴定管 D.50 mL酸式滴定管 |
|
| 4. 选择题 | 详细信息 |
|
最近《科学》杂志评出10大科技突破,其中“火星上‘找’到水的影子”名列第一、下列关于水的说法中正确的是( ) A.水的离子积仅适用于纯水 B.水的电离需要通直流电 C.升高温度水的离子积增大 D.加入电解质一定会破坏水的电离平衡 |
|
| 5. 选择题 | 详细信息 |
|
下列有关实验的选项正确的是 ( ) A.  X若为苯,可用于吸收NH3或HCl,并防止倒吸 X若为苯,可用于吸收NH3或HCl,并防止倒吸B.  除去CO中的CO2 除去CO中的CO2C.  可用于分离C2H5OH和H2O的混合物 可用于分离C2H5OH和H2O的混合物D.  记录滴定终点读数为12.20 mL 记录滴定终点读数为12.20 mL |
|
| 6. 选择题 | 详细信息 |
|
下列离子方程式中,属于水解反应的是( ) A.HCOOH C.NH3·H2O |
|
| 7. 选择题 | 详细信息 |
|
下列方法中,不能使醋酸溶液中 CH3COOH⇌CH3COO- +H+ 电离程度增大的是 A.升高温度 B.加水稀释 C.加入少量醋酸钠固体 D.加入少量氢氧化钠固体 |
|
| 8. 选择题 | 详细信息 | |||||||||||||||||||||||||
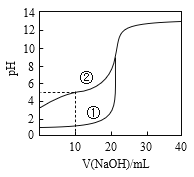
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考图示仪器,从下表中选出符合题意选项 ( ) 
A.A B.B C.C D.D |
||||||||||||||||||||||||||
| 9. 选择题 | 详细信息 | |||||||||||||||
下列“实际应用”对应“化学知识原理”说法不正确是( )
|
||||||||||||||||
| 10. 选择题 | 详细信息 |
|
常温下,下列溶液中水的电离程度最大的是( ) A. pH=0的硫酸 B. 0.01mol/L NaOH溶液 C. pH=10的纯碱溶液 D. pH=5的氯化铵溶液 |
|
| 11. 选择题 | 详细信息 |
|
物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( ) A. KX、KZ、KY B. KX、 KY、KZ C. KZ、KY 、KX D. KY、KZ、KX |
|
| 12. 选择题 | 详细信息 |
|
在25℃时,将pH=13的强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( ) A.9:1 B.1:11 C.1:9 D.11:1 |
|
| 13. 选择题 | 详细信息 |
|
下列变化过程,属于放热反应的是( ) ①液态水变成水蒸气 ②酸碱中和反应 ③浓H2SO4稀释 ④固体NaOH溶于水 ⑤H2在Cl2中燃烧. A.②③④⑤ B.②③④ C.②⑤ D.①③⑤ |
|
| 14. 选择题 | 详细信息 |
锌铜原电池装置如图所示,下列说法正确的是( )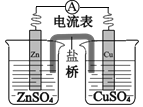 A.电流从锌片流向铜片 B.锌电极的反应式:Zn − 2e-=Zn2+ C.铜片作负极 D.盐桥的作用是传递电子 |
|
| 15. 选择题 | 详细信息 | ||||||||||
常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是
|
|||||||||||
| 16. 选择题 | 详细信息 |
|
下列溶液中有关物质的量浓度关系不正确的是 A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,溶液pH=4:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
|
| 17. 选择题 | 详细信息 |
|
常温时,下列溶液中微粒的物质的量浓度关系正确的是( ) A. 0.1mol/L B. 0.1mol/L的 C. D. 将0.1mol/L的 |
|
| 18. 选择题 | 详细信息 |
|
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确是( ) A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242 kJ/mol B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ/mol C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242 kJ/mol D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ/mol |
|
| 19. 选择题 | 详细信息 |
|
下列说法中,正确的是 A.KW随温度、浓度的改变而改变 B.凡是能自发进行的化学反应,一定是△H<0、△S>0 C.对已达到化学平衡的可逆反应,改变压强,平衡常数(K)一定改变 D.常温下,0.1mol·L-1的醋酸溶液中加入水可使平衡向电离方向移动,溶液中  的比值不变 的比值不变 |
|
| 20. 选择题 | 详细信息 |
|
下列关于盐类水解的应用中,说法正确的是( ) A.CH3COONa溶液中c(Na+)>c(CH3COO﹣) B.某盐溶液呈酸性,该盐一定发生了水解反应 C.配制FeSO4溶液要加入铁粉,配制SnCl2溶液要加入盐酸,二者原理相同 D.将Al2(SO4)3溶液蒸干后得到Al(OH)3固体 |
|
| 21. 选择题 | 详细信息 |
25℃时,将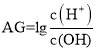 ,下列分析不正确的是( ) ,下列分析不正确的是( )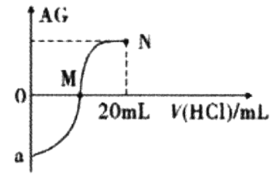 A.滴定前 B.M点时溶液中 C.从M点到N点水的电离程度先增大后减小 D.N点溶液中: |
|
| 22. 选择题 | 详细信息 |
常温下,用0.1 mol·L1KOH溶液滴定10 mL 0.1 mol·L1 HA溶液的滴定曲线如图所示。下列说法不正确的是( ) A.a≈3,说明HA属于弱酸 B.水的电离程度:d点>c点 C.e点溶液中:c(K+)=2c(A-)+2c(HA) D.b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-) |
|
| 23. 填空题 | 详细信息 |
|
学好化学有助于理解生活中化学现象的本质,从而提高生活质量。 (1)醋汤过酸时,加入少量的面碱(Na2CO3)可以减弱酸味,发生反应的离子方程式是___________。 (2)盐碱地(含较多NaCl、Na2CO3)不利于农作物生长,通过施加适量石膏可以降低土壤的碱性。试用离子方程式表示盐碱地呈碱性的原因:___________。 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题: (3)25℃时,①中由水电离出的H+浓度为___________mol·L-1. (4)④中各离子浓度由大到小的顺序是___________。 (5)②和④等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=___________mol·L-1. (6)已知t℃时,Kw=1×10-13,则t℃(选填“>”、“<”或“=”)___________25℃。在t℃时,将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___________。 |
|
| 24. 实验题 | 详细信息 | |||||||||
准确移取25.00 mL某未知浓度的盐酸溶液于-洁净的锥形瓶中,然后用0.2000 mol/L的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
(1)准确移取25.00 mL某未知浓度的盐酸溶液的仪器名称是___________。 |
||||||||||
| 25. | 详细信息 | ||||||||
|
I.高炉炼铁发生的主要反应为: 该反应在不同温度下的平衡常数如下。
(1)该反应的平衡常数表达式K=______。 |
|||||||||
| 26. | 详细信息 |
|
FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题: Kh=2.5×10-5 (1)FeCl3净水的原理是___________。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,向Fe(OH)3胶体中滴加盐酸,现象为___________。 (2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=___________mol•L-1. (3)FeCl3在溶液中分三步水解: Fe3++H2O Fe(OH)2++H2O 以上水解反应的平衡常数K1、K2、K3由大到小的顺序是___________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O a.降温 b.加水稀释 c. 加入NaHCO3 d.加入NH4Cl (4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:  ①电解过程中阳极的电极反应式为___________。 ②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中___________(填“石墨”或“铁丝网”)连接,电极b的反应式为___________。  |
|