山东省潍坊昌乐县第二中学2020届高三上半年期末化学模拟免费试题带答案和解析一
| 1. 选择题 | 详细信息 |
|
《梦溪笔谈》中“器用”篇记载:“古法以牛革为矢服,卧则以为枕,取其中虚,附地枕之,数里内有人马声,则皆闻之。盖虚能纳声也。”其中“牛革”的主要成分是( ) A.油脂 B.纤维素 C.淀粉 D.蛋白质 |
|
| 2. 选择题 | 详细信息 |
|
2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是 A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” B. 我国发射“嫦娥三号”卫星所使用的碳纤维是一种非金属材料 C. 用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用 D. 碳纳米管表面积大,可用作新型储氢材料 |
|
| 3. 选择题 | 详细信息 |
|
某绿色溶液A含有H+、Na+、Mg2+、Fe2+、Cu2+、SO ①向溶液中滴加少量 ②取滤液B,先用HNO3酸化,再滴加0.001 mol·Lˉ1 AgNO3溶液,有白色沉淀生成。 下列说法不正确的是 A.溶液A中一定存在H+、SO B.溶液A中不存在Mg2+、CO C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3 D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可用NaOH溶液判断 |
|
| 4. 选择题 | 详细信息 | ||||||||||||||||||
几种短周期元素的原子半径及主要化合价如下表:
|
|||||||||||||||||||
| 5. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A.氯化钠与浓硫酸混合加热:H2SO4+2Cl- B.FeBr2溶液与足量Cl2反应2Fe2++2Br-+2Cl2=2Fe3++4Clˉ+Br2 C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+ D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+ |
|
| 6. 选择题 | 详细信息 |
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的的是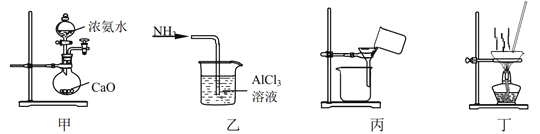 A. 用装置甲制取 NH3 B. 用装置乙制备 Al(OH)3 C. 用装置丙过滤并洗涤 Al(OH)3 D. 用装置丁灼烧 Al(OH)3得 Al2O3 |
|
| 7. 选择题 | 详细信息 |
已知:三元轴烯 (a)、四元轴烯 (a)、四元轴烯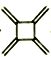 (b)、五元轴烯 (b)、五元轴烯 (c)的最简式都与苯相同,下列说法不正确的是 (c)的最简式都与苯相同,下列说法不正确的是A. 三种物质都能发生加成反应 B. a、b分子中所有原子都在同一个平面上 C. a 与 |
|
| 8. 选择题 | 详细信息 |
|
W、X、Y、Z都是元素周期表中前20号的元素.W的阳离子与Y的阴离子具有相同的电子层结构,且能形成化合物WY;Y和Z属同族元素,它们能形成两种常见化合物;X和Z属于同一周期元素,它们能形成两种常见气态化合物;W和X能形成化合物WX2,X和Y不在同一周期,它们能形成组成为XY2的化合物.关于W、X、Y、Z的说法正确的是( ) A. 气态氢化物稳定性:X>Z B. 最高价氧化物对应的水化物酸性:X<Y C. 化合物WX2和XY2均为共价化合物 D. W、Y、Z的简单离子半径:W>Y>Z |
|
| 9. 选择题 | 详细信息 |
|
近年来我国科学家发现了一系列铁系超导材料,其中一类为Fe—Nd—B—N组成的化合物。下列说法正确的是 A.B元素位于元素周期表的d区 B.基态Fe原子核外电子占据的轨道总数为13 C.Nd的价层电子排布式为4f46s2,则Nd2+价层电子排布式为4f26s2 D.氨硼烷(NH3·BH3)中N、B原子均采取sp3杂化 |
|
| 10. 选择题 | 详细信息 |
下列图示与对应的叙述符合的是( )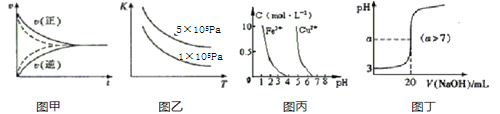 A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化 B.图乙表示反应2SO2(g)+O2(g) C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右 D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加0.001mol/L的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系 |
|
| 11. 选择题 | 详细信息 |
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法正确的是 A.电池工作时,负极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B.电池放电时间越长,电池中的Li2S2量越多 C.手机使用时电子从b电极经过手机电路版流向a电极,再经过电池电解质流回b电极 D.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14g |
|
| 12. 选择题 | 详细信息 |
丁苯酞是一种治疗急性脑缺血的药物,部分合成流程如下。下列说法错误的是( ) A.化合物X、Y和丁苯酞三种分子中各含有1个手性碳原子 B.化合物Y可以发生取代、氧化和还原反应 C.可用Na2CO3溶液鉴别化合物X和化合物Y D.化合物X、Y和丁苯酞各1 mol最多消耗NaOH的量均为1 mol |
|
| 13. 选择题 | 详细信息 |
Hg是水体污染的重金属元素之一.水溶液中二价汞主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是 A.少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是HgCl2 B.Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是水解生成Hg(OH)2 C.HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- D.当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
|
| 14. 选择题 | 详细信息 |
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法错误的是( )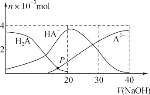 A.在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+) B.当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A) C.当V(NaOH)=30 mL时,2c(Na+)=3[c(HA-)+c(A2-)+c(H2A)] D.当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+) |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||||||||||
甲胺
|
|||||||||||||||||||||||||||||||||||||||
| 16. 综合题 | 详细信息 |
|
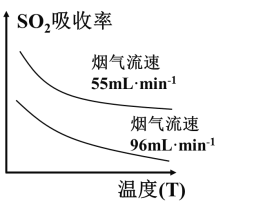
乙醇是一种重要的化工原料,在生活、生产中的应用广泛。 (1)工业上利用二甲醚合成乙醇 反应①:CH3OCH3(g) + CO(g) 反应②:CH3COOCH3(g) + 2H2(g) 一定压强下,温度对二甲醚和乙酸甲酯平衡转化率影响如下图1所示,据图示判断,△H2________0(填“>”或“<”)。温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如下图2所示。在300K~600K范围内,乙酸甲酯的百分含量逐渐增加,而乙醇的百分含量逐渐减小的原因是_____________。   (2)乙醇加入汽油(平均分子式为C8H18)中能改善油品质量,减少对环境的影响。 ①乙醇汽油可提高燃油的燃烧效率,减少CO等不完全燃烧产物的生成。相同条件下,等物质的量的乙醇与汽油完全燃烧消耗氧气之比为_____________。  ②NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag−ZSM−5为催化剂,测得NO转化为N2的转化率随温度变化情况如上图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____________;在 (3)某乙醇燃料电池采用碱性介质,该电池工作时负极的电极反应式为____________。 |
|
| 17. | 详细信息 |
|
含Ti化合物在工业生产中有着重要用途。TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。 nCH2=CHCH3 (1)Ti3+的基态核外电子排布式为__________; (2)丙烯分子中,碳原子轨道杂化类型为__________; (3)Mg、Al、Cl第一电离能由大到小的顺序是___________; (4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式____; (5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______; (6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为_________。若两个O原子之间的最近距离为anm,则该晶胞的边长为________,阿伏伽德罗常数常数为NA,则该晶胞的密度的计算式ρ=_______g/cm3(用含a、NA的代数式表示)  |
|
| 18. | 详细信息 |
|
铁黄(FeOOH)是一种不溶于水的黄色固体,可用作制造黄色颜料,也是制备高铁酸钾的原料。以下是实验室制备铁黄的一种方法: ①称取一定质量FeSO4溶于适量蒸馏水配成物质的量浓度约为0.4mol/L的溶液并加稀H2SO4调节溶液pH≈2; ②把配制好的溶液加入三颈烧瓶中,再加入适量NaNO2固体和磁力搅拌核,按下图连接好装置,A、B处均装有KOH溶液;  ③打开旋塞M、N,开启恒温磁力搅拌器,控制加热温度为40℃,从a口通入空气; ④反应过程中,控制溶液pH为2.0±0.5,当反应液变为亮黄色时,停止反应; ⑤待反应液冷却后,过滤洗涤并干燥所得沉淀。 Ⅰ.(1)NaNO2在反应中起催化剂作用,实际起催化作用的是其与加稀H2SO4反应生成的气体,该反应的离子方程式为___________,制备铁黄的总反应离子方程式为__________。 (2)A处KOH溶液的作用为_____________。 (3)步骤⑤中判断沉淀洗涤干净的方法是____。 (4)某学生利用减压过滤的抽气泵,也实现了为装置持续通入空气的目的,他的具体操作方法是___________。  (5)改变不同的实验条件,发现适当的空气流速、合适的pH和温度(40℃)、增加催化剂用量都能够提高产率。温度过高或过低均影响产率的原因是(不考虑副反应)____________。 Ⅱ.某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。  (1)据图可知,反应时需要控制的适宜温度是____℃,要达到此要求需要采取的措施是___。 (2)已知:黄铁矿中的硫元素在酸性条件下可被 (3)该小组拟以“m(ClO2)/m(NaC1O3)”作为衡量ClO2产率的指标。取NaClO3样品6.0g,通过反应和吸收获得400mLClO2溶液,取此溶液20mL与37.00mL0.500mol/L(NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.0500mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。反应原理为:4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O,l4H++ |
|
| 19. | 详细信息 | |||||||||||||||
锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下: 已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。 ②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
|
||||||||||||||||
| 20. 推断题 | 详细信息 |
酒石酸托特罗定主要用于治疗泌尿系统疾病。工业合成该药物的中间体(F)的路线如下: 回答下列问题: (1)D分子中的含氧官能团名称为 __________;B→C包含两步反应,反应类型分别为_______、_______; (2)A的结构简式为________; (3)写出苯甲醛与银氨溶液反应的化学方程式 _______; (4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________; ①能使溴的CCl4溶液褪色;②能与FeCl3溶液发生显色反应;③苯环上的一氯代物有一种;④分子中有4种不同化学环境的氢。 (5)已知呋喃丙胺( |
|