高二下册期末考试化学题免费在线检测(2019-2020年吉林省实验中学)
| 1. 选择题 | 详细信息 |
|
化学与材料、生活和环境密切相关。下列有关说法中正确的是( ) A. 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 C. “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 D. 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的一组是( ) ①不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③0.5 mol·L-1一元酸溶液中H+浓度为0.5 mol·L-1 ④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度 ⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子 ⑥熔融的电解质都能导电 A.①③⑤⑥ B.只有④⑤ C.②④⑤⑥ D.只有③⑥ |
|
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.1 mol OD-和17 g —OH所含的质子与中子均为9NA B.7.8 g Na2S与Na2O2的混合物,含离子总数为0.3NA C.1 mol FeI2与足量氯气反应时转移的电子数为2NA D.0.1 mol·L-1氯化铜溶液中氯离子数为0.2NA |
|
| 4. 选择题 | 详细信息 |
|
纵观古今,化学与生活皆有着密切联系。下列说法错误的是( ) A. 《本草图经》在绿矾项载:“盖此矾色绿,味酸,烧之则赤…”。因为绿矾能电离出H+,所以有“味酸”. B. 《天工开物》记载:“凡白土曰垩土,为陶家精美器用”。陶是一种传统硅酸盐材料 C. “水声冰下咽,沙路雪中平”描述的是水的三态变化:“冰,水为之,而寒于水”,说明冰转化为水吸热 D. 唐未《真元妙道要略)中有云:“以硫黄、雄黄合硝石并蜜烧之;焰起,烧手面及烬屋舍者”,文中描述的是黑火药的制作过程 |
|
| 5. 选择题 | 详细信息 |
某学生以铁丝和Cl2为原料进行下列三个实验。从分类角度下列分析正确的是 A.实验①、③反应制得的物质均为纯净物 B.实验②、③均未发生氧化还原反应 C.实验②、③均为放热反应 D.实验①、②所涉及的物质均为电解质 |
|
| 6. 选择题 | 详细信息 |
|
500 mL 2 mol·L-1FeCl3溶液和500 mL 2 mol·L-1明矾溶液分别滴入沸水中,加热制成分散系甲、乙,经测定,甲分散系中分散质的粒子直径大小在1~100 nm之间,乙分散系中分散质的粒子直径大小在10-9~10-7m之间。下列关于甲、乙分散系的判断合理的是( ) A.在暗室里用一束明亮的“强光”照射甲、乙,发现甲、乙均有丁达尔效应 B.向甲、乙中分别滴加过量的氢氧化钠溶液,现象都是“先聚沉,后溶解” C.向甲、乙中分别滴加过量的氢碘酸,最终现象分别是深褐色溶液、白色沉淀 D.蒸干、灼烧FeCl3溶液和明矾溶液会得到对应的固体盐 |
|
| 7. 选择题 | 详细信息 |
|
下列用系统命名法命名有机物名称正确的是( ) A.2-甲基-4-乙基戊烷 B.2-羟基-3-甲基戊烷 C.2,3-二乙基-1-戊烯 D.1,2-二甲基-1-丁醇 |
|
| 8. 选择题 | 详细信息 |
|
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是 ( ) A.萃取是常用的有机物提纯方法 B.燃烧法是研究确定有机物成分的有效方法之一 C.核磁共振氢谱通常用于分析有机物的相对分子质量 D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
|
| 9. 选择题 | 详细信息 |
|
下列各组离子在指定的溶液中,能大量共存的是( ) ①酸性溶液中:Fe2+、Al3+、 ②pH=13的溶液:Na+、 ③水电离出来的c(H+)=10-13 mol/L的溶液: ④加入铝片能放出H2的溶液:Na+、 ⑤滴加石蕊试液显红色的溶液:Fe3+、 A.①② B.②③ C.②④⑤ D.②⑤ |
|
| 10. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A.钠与水反应:Na + 2H2O = Na++ 2OH-+ H2↑ B.硅酸钠溶液与醋酸溶液混合:SiO32- + 2H+= H2SiO3↓ C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-= 2BaSO4↓ + Al(OH)3↓ + NH3·H2O D.浓硝酸中加入过量铁粉并加热:Fe + 3NO3-+ 6H+ |
|
| 11. 选择题 | 详细信息 |
|
含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6ClF3=6CoF3+3Cl2+4X。下列有关该反应的说法,正确的是( ) A.X与O3互为同位素 B.1 mol Co3O4在反应中转移9 mol电子 C.ClF3中氯元素为-3价 D.Co3O4在反应中作氧化剂 |
|
| 12. 选择题 | 详细信息 | |||||||||||||||
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
|
||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列说法错误的是( ) A.利用丁达尔效应可区分淀粉溶液与葡萄糖溶液 B.某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 C.用过滤法无法除去Fe(OH)3胶体中的FeCl3 D.向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质 |
|
| 14. 选择题 | 详细信息 |
|
将由Al、CuO、Fe2O3组成的混合物10.0 g放入250 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2.0 mol·L-1的NaOH溶液时,得到的沉淀最多。该盐酸的浓度为( ) A.0.5 mol·L-1 B.3.0 mol·L-1 C.2.0 mol·L-1 D.1.0 mol·L-1 |
|
| 15. 选择题 | 详细信息 |
常温下,在pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I-、Cl- 、 A.Fe2+、I-、Cl-三种离子一定存在 B. C.Fe3+与Fe2+至少有一种 D.该溶液中c(Cl-)至少为0.2mol•L‑1 |
|
| 16. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是( ) A.在NH4Al(SO4)2溶液中滴加少量烧碱溶液:Al3++4OH-= B.在含等物质的量浓度的Na2CO3和NaOH溶液中滴加过量的盐酸: C.在Mg(HCO3)2溶液中滴加过量的澄清石灰水:Mg2++2 D.在Fe(NO3)2稀溶液中滴加少量NaHSO4溶液:Fe2++ |
|
| 17. 选择题 | 详细信息 |
|
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是 A. B. C. D. |
|
| 18. 选择题 | 详细信息 | |||||||||||||||
下列实验操作能达到实验目的的是( )
|
||||||||||||||||
| 19. 选择题 | 详细信息 |
|
某学生配制了100mL 1mol/L的硫酸溶液。然后,对溶液浓度做精确测定,且测定过程中一切操作都正确。结果测得溶液的物质的量浓度低于1mol/L.那么,在配制过程中,下列操作可能导致溶液浓度偏低的是( ) ①量筒用蒸馏水洗净后立即用来量取浓硫酸 ②将浓硫酸在烧杯中稀释,转移到容积为100mL的容量瓶中后,没有洗涤烧杯 ③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面 ④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切。 A.②③④ B.③④ C.①②③ D.①②③④ |
|
| 20. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.标准状况下,4.48 L己烷含有的分子数为0.2NA B.15 g甲醛(HCHO)和乙酸的混合物中氧原子数为0.5NA C.8.8 g乙酸乙酯中含共用电子对的数目为1.3NA D.1 mol甲基(—14CD3)所含的中子数和电子数分别为11NA、10NA |
|
| 21. | 详细信息 |
|
某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 ml Cl2,恰好将Fe2+完全氧化。x值为( ) A. 0.80 B. 0.85 C. 0.90 D. 0.93 |
|
| 22. | 详细信息 | ||||||||||
|
已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、 (1)根据下列实验步骤和现象,推断实验结论:
|
|||||||||||
| 23. 实验题 | 详细信息 |
|
人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。 (配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。 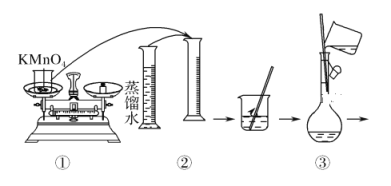  (1)请你观察图示判断,其中不正确的操作有(填序号)________。 (2)其中确定50 mL溶液体积的容器是(填名称)________。 (3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。 (测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。 (4)已知草酸跟KMnO4溶液反应的离子方程式为: 2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。 (5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。 |
|
| 24. | 详细信息 |
辣椒素是辣椒的活性成分,可在口腔中产生灼烧感,能够起到降血压和胆固醇的功效,进而在很大程度上预防心脏病,也能缓解肌肉关节疼痛。辣椒素酯类化合物的结构可以表示为: (R为烃基) (R为烃基)其中一种辣椒素酯类化合物J的合成路线如下: 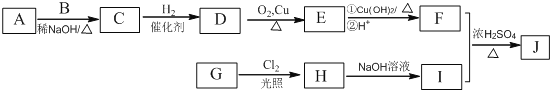 已知: ①A、B和E为同系物,其中B的相对分子质量为44,A和B核磁共振氢谱显示都有两组峰; ②化合物J的分子式为C15H22O4; 回答下列问题: (1)G所含官能团的名称为_____。 (2)由A和B生成C的化学方程式为_____。 (3)由C生成D的反应类型为_____,D的化学名称为_____。 (4)由H生成I的化学方程式为_____。 (5)J的结构简式为_____。 (6)G的同分异构体中,苯环上的一氯代物只有一种的共有_____种(不含立体异构),核磁共振氢谱显示2组峰的是_____(写结构简式)。 |
|




