宣城市高二化学2019年后半期期末考试在线答题
| 1. 选择题 | 详细信息 |
2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下: 下列说法不正确的是 A.元素甲位于现行元素周期表第四周期第ⅢA族 B.元素乙的简单气态氢化物的稳定性强于CH4 C.原子半径比较:甲>乙>Si D.推测乙可以用作半导体材料 |
|
| 2. 选择题 | 详细信息 |
|
苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( ) A. 脱落酸 B. 生长素 C. 乙烯 D. 甲烷 |
|
| 3. 选择题 | 详细信息 |
|
化学与社会、生活密切相关,下列有关说法中不正确的是 A.硅胶多孔,常用作食品干燥剂 B.氨易液化,常用作制冷剂 C.飞机播撒AgI是实现人工降雨的一种方法 D.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 |
|
| 4. 选择题 | 详细信息 |
|
已知NA是阿伏加德罗常数的值,下列说法错误的是 A.1mol N2和3mol H2在一定条件下充分反应后,分子数大于2NA B.1L0.1mol·L-1碳酸钠溶液中含有的阴离子数目大于0.1NA C.5.6gFe和2.24L(标准状况)Cl2反应转移电子数为0.3NA D.48g正丁烷和10g异丁烷的混合物中共价键数目为13NA |
|
| 5. 选择题 | 详细信息 |
|
下列关于有机物a( A. a、b、c互为同分异构体 B. a、b、c均能使酸性KMnO4溶液褪色 C. a、b、c的一氯代物分别有5种、2种、1种 D. 有机物 a中的所有原子均可能处于同一平面内 |
|
| 6. 选择题 | 详细信息 |
|
X、Y、Z、W为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期;Y2常用做保护气,一般由分离液态空气得到;非金属Z的一种固体单质可导电;W的阳离子与X的阳离子核外电子数相同。下列说法正确的是 A.四种元素简单离子半径:W>X>Y>Z B.X、Y、W的最高价氧化物的水化物可两两发生反应 C.气态氢化物沸点最高的是Z的氢化物 D.Y2在一定条件下可与W的单质发生化学反应 |
|
| 7. 选择题 | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是 A.实验室中常用排饱和食盐水的方法收集Cl2 B.洗涤油污时热的纯碱溶液比冷的纯碱溶液效果更好 C.浓氨水中加入氢氧化钠固体时产生刺激性气味的气体 D.工业上使用催化剂提高SO2与O2合成SO3的效率 |
|
| 8. 选择题 | 详细信息 |
|
下列变化与原电池原理有关的是 A.金属钠的新切面很快会失去金属光泽 B.红热的铁丝与冷水接触,表面形成蓝黑色保护层 C.Zn与稀硫酸反应时,滴入几滴CuSO4溶液可加快反应 D.酸性KMnO4溶液与H2C2O4溶液反应时加入少量MnSO4固体,反应加快 |
|
| 9. 选择题 | 详细信息 |
绿水青山是习.平总书记构建美丽中国的伟大构想,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程: 已知:NO+NO2+2OH-=2NO2-+H2O 下列说法正确的是 A.固体1中主要含有CaCO3、CaSO4 B.X可以是空气,且需过量 C.处理含NH4+废水时,发生的反应为:NH4++5NO2-+4H+=6NO D.捕获剂所捕获的气体主要是CO |
|
| 10. 选择题 | 详细信息 |
|
实验室利用乙醇催化氧化法制取并提纯乙醛的实验过程中,下列装置未涉及的是( ) A.  B. B.  C. C.  D. D.  |
|
| 11. 选择题 | 详细信息 | ||||||||||
制备金属钾的反应:Na+KCl
|
|||||||||||
| 12. 选择题 | 详细信息 |
下图为工业合成氨的流程图。图中为提高原料转化率而采取的措施是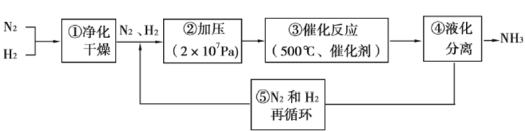 A.①②③ B.①③⑤ C.②④⑤ D.②③④ |
|
| 13. 选择题 | 详细信息 |
某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构): 下列说法不正确的是 A. HAP能提高HCHO与O2的反应速率 B. HCHO在反应过程中,有C-H键发生断裂 C. 根据图示信息,CO2分子中的氧原子全部来自O2 D. 该反应可表示为:HCHO+O2 |
|
| 14. 选择题 | 详细信息 |
MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰: 下列说法错误的是 A.装置Ⅰ烧瓶中放入的药品X为铜屑 B.装置Ⅱ中用“多孔球泡”可增大SO2的吸收速率 C.装置Ⅲ用于吸收未反应的SO2 D.用装置II反应后的溶液降温结晶可制得MnSO4·H2O晶体 |
|
| 15. 选择题 | 详细信息 |
元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是 A. 电池工作时,直接将太阳能转化为电能 B. 理论上,n(被还原的I3-):n(被氧化的Ru II*)=1:2 C. 在周期表中,钌位于第五周期第ⅧB族 D. 电池工作时,正极的电极反应式为Ru3++e-=Ru2+ |
|
| 16. 选择题 | 详细信息 |
常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知: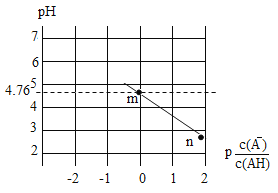 A. Ka(HA)的数量级为10-5 B. 滴加NaOH溶液的过程中, C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-) D. n点所示溶液中:c(Na+)=c(A-)+c(HA) |
|
| 17. 推断题 | 详细信息 |
X、Y、Z、W、M、R六种短周期元素,周期表中位置如下: 试回答下列问题: (1)X、Z、W、R四种元素的原子半径由大到小的排列顺序是______(用元素符号表示)。 (2)由X、Z、W、R四种元素中的三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为_____________________________。 (3)由X、W、M、R四种元素组成的一种离子化合物A,已知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_________________________________。 (4)分子式为X2Y2W4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是____________________(用方程式及必要的文字说明)。0.1mol·L-1该溶液中各离子浓度由大到小的顺序为________________________。 (5)由X、Z、W、R和Fe五种元素可组成类似明矾的化合物T(相对分子质量为392),1molT中含有6mol结晶水。对化合物T进行如下实验: a.取T的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色; b.另取T的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。 则T的化学式为_____________________。 |
|
| 18. 实验题 | 详细信息 |
|
碘化钾是一种无色晶体,易溶于水。实验室制备KI晶体的步骤如下: Ⅰ.在如下图所示的三颈烧瓶中加入研细的I2和一定量的30%KOH溶液,搅拌(已知:I2与KOH反应产物之一是KIO3); Ⅱ.碘完全反应后,打开分液漏斗中的活塞、弹簧夹1、2,向装置C中通入足量的H2S; Ⅲ.反应结束后,向装置C中加入稀H2SO4酸化,水浴加热; Ⅳ.冷却,过滤得KI粗溶液。  (1)仪器a的名称是__________,步骤Ⅰ中控制KOH溶液过量的目的是______________。 (2)装置B的作用是_____________,装置D中盛放的溶液是________________。 (3)装置C中H2S和KIO3反应的离子方程式为_______________________。 (4)步骤Ⅲ中水浴加热的目的是除去_________________________(填化学式)。 (5)由步骤Ⅳ所得的KI粗溶液中含有少量K2SO4,需进行提纯,提纯流程如下: 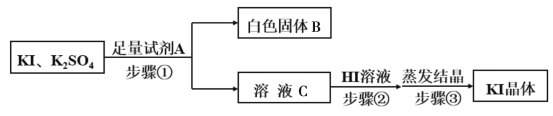 ①已知白色固体B是混合物,试剂A为__________,为除去溶液C中的杂质,步骤②中调节溶液为弱酸性,则加入HI溶液后产生的现象是___________________。 ②为测定最后所得KI晶体的纯度,取a g晶体配制100mL溶液,取出25mL溶液,滴入足量稀的酸性K2Cr2O7溶液,充分反应后,滴加几滴淀粉溶液为指示剂,用b mol·L-1的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液VmL。 滴定过程中涉及的反应为: |
|
| 19. 综合题 | 详细信息 | ||||||||||||||||||||||||
|
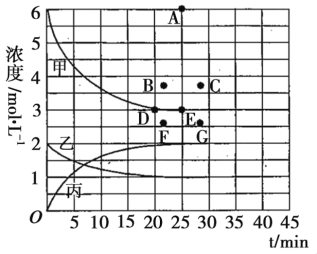
工业合成氨反应为:N2(g)+3H2(g) (1)已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是946kJ·mol-1,则上述反应的ΔH=_________________。 (2)上述反应的平衡常数K的表达式为____________,若反应方程式改写为NH3(g) (3)在773K时,分别将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
|
|||||||||||||||||||||||||
| 20. | 详细信息 |
以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下: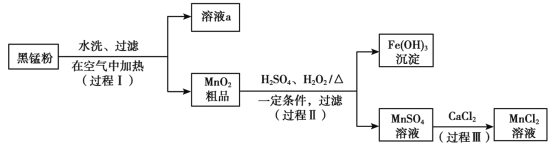 (1)过程Ⅰ中,在空气中充分加热黑锰粉的目的主要是除去__________和氧化锰元素,请写出含Mn元素的物质发生反应的化学方程式____________________________。 (2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。根据右图所示的溶解度曲线,将溶液a经___________、_______________、过滤可得NH4Cl粗品。  (3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入____________(填试剂和现象),证明溶液中Fe3+沉淀完全。 (4)探究过程Ⅱ中MnO2溶解的适宜条件。 ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。 ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。 ①用化学方程式表示ⅱ中MnO2溶解的原因:__________________。 ②解释试剂加入顺序不同,MnO2作用不同的原因:_______________________。 上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。 |
|
最近更新