高一上期期末考试化学题免费试卷(2019-2020年湖南省长沙市雨花区)
| 1. 选择题 | 详细信息 |
|
十九大报告提出“坚持保护环境,建设美丽中国”,下列物质不属于空气污染物的是 A. SO2 B. NO2 C. PM2.5 D. CO2 |
|
| 2. 选择题 | 详细信息 |
|
下列属于合金的是 A. 不锈钢餐具 B. 大理石地板 C. 石墨棒电极 D. 水银温度计 |
|
| 3. 选择题 | 详细信息 |
|
下列变化需要加入还原剂才能实现的是 A.Fe C.MnO |
|
| 4. 选择题 | 详细信息 |
|
当光束通过下列物质时,不可能观察到丁达尔现象的是 A. 豆浆 B. NaCl溶液 C. 蛋白质溶液 D. Fe(OH)3胶体 |
|
| 5. 选择题 | 详细信息 |
|
下列关于物质的分类正确的是 A. 烧碱、纯碱均属于碱 B. 氨水、液氯均属于电解质 C. H2SO4、NH3均属于酸 D. SO2、CO2均属于酸性氧化物 |
|
| 6. 选择题 | 详细信息 |
|
实验室进行粗盐提纯,无需进行的操作是 A. 分液 B. 溶解 C. 过滤 D. 蒸发 |
|
| 7. 选择题 | 详细信息 |
|
配制一定物质的量浓度的NaCL溶液,下列操作会使溶液浓度偏高的是 A. 少量NaCl固体残留在称量纸上 B. 溶解NaCl的烧杯中有少量蒸馏水 C. 转移溶液时没有洗涤烧杯和玻璃棒 D. 定容时液面最高处与刻度线相平 |
|
| 8. 选择题 | 详细信息 |
|
下列对Na与H2O反应现象的描述不正确的是 A. Na熔成光亮小球 B. Na沉在水底 C. 反应发出嘶嘶的响声 D. 滴入酚酞后溶液呈红色 |
|
| 9. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是 A. H2SO4的摩尔质量为98g B. 标准状况下,22.4LH2O含有的分子数为NA C. 常温常压下,71gCl2含有的氯原子总数为2NA D. 0.1mol·L-1BaCl2溶液中,Cl-的物质的量浓度为0.1mol·L-1 |
|
| 10. 选择题 | 详细信息 |
|
下列反应不属于氧化还原反应的是 A.Fe+CuSO4=FeSO4+Cu B.NH4HCO3 C.Cl2+H2O D.Fe2O3+3CO |
|
| 11. 选择题 | 详细信息 |
|
下列反应的离子方程式中,正确的是 A. 铁和稀盐酸反应:2Fe+6H+ === 2Fe3++3H2↑ B. 盐酸与碳酸钙反应:2H++CO32- === CO2↑+H2O↑ C. 用NaOH溶液吸收少量SO2:SO2+OH- === HSO3-+H2O D. 氯气通入氢氧化钠溶液:Cl2+2OH- === Cl-+ClO-+H2O |
|
| 12. 选择题 | 详细信息 |
|
下列各组离子能在溶液中大量共存的是 A.K+、Cu2+、NH4+、OH- B.Na+、SO C.Na+、H+、Fe2+、NO |
|
| 13. 选择题 | 详细信息 |
|
下列关于物质性质的说法错误的是 A. 小苏打可用于治疗胃酸过多 B. 氯化铁溶液可用于刻制含铜箔的印刷电路板 C. 漂白粉久置于空气中会与水、二氧化碳反应而失效 D. 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变蓝后褪色 |
|
| 14. 选择题 | 详细信息 |
|
下列物质的用途不正确的是 ①Ca(ClO)2是84消毒液的有效成分 ②Fe2O3可用作红色涂料 ③氢氧化铁胶体能用于净水和杀菌消毒 ④液氨可用作制冷剂 ⑤Na2O2可用作潜水艇的供氧剂 ⑥H2O2可用作绿色氧化剂 ⑦二氧化硫可用来漂白馒头 ⑧钠失火后可用二氧化碳作灭火剂 A. ①③⑦⑧ B. ①②⑦⑧ C. ①③④⑤ D. ②③⑤⑦ |
|
| 15. 选择题 | 详细信息 |
|
下列说法正确的是 A. 某试样焰色反应呈黄色,则试样中一定含有K+ B. 用Ba(OH)2溶液来鉴别NH4Cl、(NH4)2SO4、K2SO4 C. 向某溶液中滴加盐酸酸化的BaCl2溶液产生白色沉淀,该溶液一定含有SO42- D. 定容时不慎使液面高于容量瓶的刻度线,可用滴管将多余液体吸出 |
|
| 16. 选择题 | 详细信息 |
|
将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是 A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1 |
|
| 17. 实验题 | 详细信息 |
下列为实验室常用仪器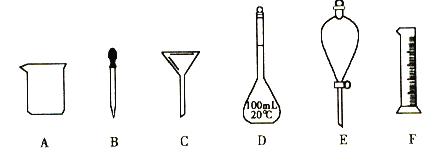 (1)下列各组混合物中,能用仪器E进行分离的是____________。 a.水和四氯化碳 b.碘和酒精 c.水中的泥沙 (2)配制100mL0.1mol·L-1NaOH溶液,所需NaOH固体的质量是_______g,实验中用到的四种仪器为_________________(填序号),还缺少的一种玻璃仪器为______________(填仪器名称)。 |
|
| 18. 实验题 | 详细信息 |
下图是某儿童微量元素体检报告单的部分数据: 根据上表的数据,回答下列问题: (1)该儿童__元素含量偏低。 (2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。 (3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__(填“氧化性”或“还原性”)。 (4)硫酸亚铁晶体(FeSO4•7H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:  请回答下列问题: a.②中H2O2的作用是__。 b.④中一系列处理的操作步骤为__、洗涤、灼烧、冷却、称量。 c.若实验无损耗,则每片补血剂含铁元素的质量分数为__。 d.下列操作会导致所测定的铁元素含量偏高的是__。 A 步骤③所加氨水量不足 B 步骤④洗涤不充分 C 步骤④灼烧不充分 |
|
| 19. | 详细信息 |
|
电子工业上使用的印刷电路板,是在敷有铜膜的塑料板上以涂层保护所要的线路,然后用三氯化铁浓溶液作用掉(腐蚀)未受保护的铜膜后形成的。某工程师为了从使用过的腐蚀废液(含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费)中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用下列步骤: (1)写出FeCl3溶液与铜箔发生反应的离子方程式:____________。 (2)检验废腐蚀液中是否含有Fe3+所需试剂名称:________,实验现象:______________。 (3)向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:___________,此转化的化学方程式为:______________。 (4)写出③中所含物质:________,⑥发生反应的离子方程式:_______。 |
|
| 20. | 详细信息 |
|
氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应: KClO 3+HCl(浓)-KCl+Cl2↑+ H2O, (1)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______; 被氧化的元素和被还原的元素的质量之比为_________。 (2)浓盐酸在反应中表现出来的性质是________________(填写编号)。 ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (3)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。 |
|
| 21. 实验题 | 详细信息 |
图中为实验室制取氯气及性质验证的装置图: 参考装置图回答下列问题: (1)请指出仪器a的名称____________________,写出装置A中反应的化学方程式____________ (2)在装置D中可观察到的现象是________,装置E中可观察到的现象是__________。 (3)装置B的作用为_____,装置C的作用为____________,装置H的作用为_________,写出装置H中的离子方程式_____________。 |
|
最近更新



