2019-2020年高一上学期期末考试化学考试(云南省玉溪市江川区二中)
| 1. 选择题 | 详细信息 |
|
把下列金属投入0.1 mol·L-1盐酸中,能发生反应且反应最剧烈的是( ) A. Cu B. Fe C. Mg D. Al |
|
| 2. 选择题 | 详细信息 |
如图所示,①②两个集气瓶装满干燥的Cl2,向两个集气瓶中依次分别投入干燥的红纸和湿润的红纸,过一段时间,红纸的变化是( )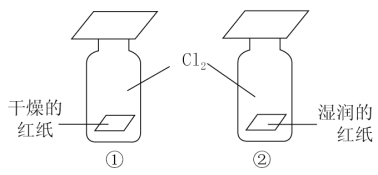 A. ①和②都褪色 B. ①和②都不褪色 C. ①褪色,②不褪色 D. ①不褪色,②褪色 |
|
| 3. 选择题 | 详细信息 |
|
在无色透明的酸性溶液中,能大量共存的离子组是( ) A.Na+、K+、 C.K+、Fe2+、 |
|
| 4. 选择题 | 详细信息 |
|
关于硅及其化合物的叙述中,正确的是 A.硅是良好的半导体材料,且是制造光缆的主要材料 B.SiO2不溶于水,也不溶于任何酸 C.可以用焦炭还原二氧化硅生产硅:SiO2+C D.SiO2是酸性氧化物,在一定条件下能和氧化钙反应 |
|
| 5. 选择题 | 详细信息 |
|
将10.6 g Na2CO3溶于水配制成1000 mL 溶液,从中取出20 mL,该溶液中Na+的物质的量浓度为( ) A. 0.1 mol/L B. 0.2 mol/L C. 0.05 mol/L D. 0.025 mol/L |
|
| 6. 选择题 | 详细信息 |
|
下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( ) A.过氧化钠和氧化钠中钠元素的化合价相同,氧元素化合价不同 B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应 C.过氧化钠和氧化钠与水反应都有氢氧化钠生成 D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物 |
|
| 7. 选择题 | 详细信息 |
|
有一瓶14%KOH溶液,加热蒸发掉100g水后,变为28%的KOH溶液80mL(蒸发过程中无溶质析出)。这80mL溶液的物质的量的浓度为 A. 5mol/L B. 6mol/L C. 6.25mol/L D. 6.75mol/L |
|
| 8. 选择题 | 详细信息 |
|
下列物质的分类采用树状分类法的是( ) A. 铁是单质又是导体 B. 纯净物可分为有机物和无机物 C. 氯化钠是钠的化合物,又是氯化物 D. 氢氧化钙既是纯净物,又是化合物,属于碱 |
|
| 9. 选择题 | 详细信息 |
|
在SO3+H2O=H2SO4反应中,反应前后发生改变的是( ) A.分子总数 B.元素种类 C.各元素化合价 D.原子种类 |
|
| 10. 选择题 | 详细信息 |
|
浓盐酸与次氯酸钙能发生反应Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质是( ) ①CO2 ②HCl ③H2O(g) ④O2 A. ①②③ B. ②③④ C. ②③ D. ①④ |
|
| 11. 选择题 | 详细信息 |
|
下列氧化物中,既能溶于强酸,又能溶于强碱的是( ) A.氧化铁 B.氧化银 C.氧化铜 D.氧化铝 |
|
| 12. 选择题 | 详细信息 |
|
下列物质对应的化学式不正确的是( ) A. 刚玉——Al2O3 B. 干冰——CO2 C. 小苏打——NaHCO3 D. 烧碱——Na2CO3 |
|
| 13. 选择题 | 详细信息 |
|
在过氧化钠与水反应中,发生氧化反应和还原反应的物质的物质的量之比是( ) A. 1∶1 B. 1∶2 C. 2∶1 D. 8∶53 |
|
| 14. 选择题 | 详细信息 |
为了净化和收集由盐酸和大理石制得的CO2气体,从下图中选择合适的的装置并连接。合理的是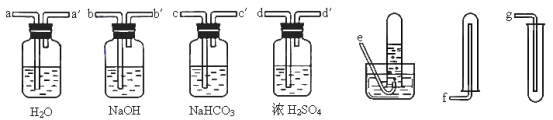 A.a-a′→d-d′→e B.b-b′→d-d′→g C.c-c′→d-d′→g D.d-d′→c-c′→f |
|
| 15. 选择题 | 详细信息 |
|
质量相等、质量分数相同的两份稀盐酸分别与碳酸钠和碳酸氢钠完全反应,消耗碳酸钠和碳氢钠的质量( ) A.碳酸钠多 B.碳酸氢钠多 C.一样多 D.无法确定 |
|
| 16. 选择题 | 详细信息 |
|
在澄清透明强酸性溶液中,能大量共存的离子组是( ) A.K+、Cu2+、OH﹣、 C.K+、Na+、Cl﹣、 |
|
| 17. 选择题 | 详细信息 |
|
下列各组物质,按电解质、非电解质、既不是电解质也不是非电解质顺序排列的是 A. 硝酸钾、硫酸铜、稀硫酸 B. 空气、水、稀硫酸 C. 氯化钠、乙醇、铜 D. 硝酸、食盐水、烧碱 |
|
| 18. 选择题 | 详细信息 |
|
常用两种方法制备氯化物:①金属与氯气直接化合;②金属与盐酸反应。用上述两种方法都可制得的氯化物是( ) A.氯化铜 B.氯化亚铁 C.氯化铁 D.氯化铝 |
|
| 19. 选择题 | 详细信息 |
|
用某溶液浸湿滤纸后置于集气瓶口,以检验瓶中是否收集满二氧化硫气体。则该溶液是( ) A.氯化钡溶液 B.酸性高锰酸钾溶液 C.碘化钾淀粉溶液 D.澄清石灰水 |
|
| 20. 选择题 | 详细信息 |
|
若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mg Na与氧气反应,生成固体的质量为( ) ①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g A.仅①④ B.仅①⑤ C.仅③④ D.①②③④⑤ |
|
| 21. 选择题 | 详细信息 |
|
下列物质中含有的分子数相等的是( ) ①0.1 mol CO ②9.8 g H2SO4 ③1 g H2O ④1.6 g O2 A. ①③ B. ②④ C. ①② D. ③④ |
|
| 22. 选择题 | 详细信息 |
|
下列有关二氧化硅的叙述中不正确的是 A.沙子、石英、水晶的主要成分都是SiO2 B.SiO2是制光导纤维的主要原料 C.硅酸可由SiO2直接制得 D.SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应 |
|
| 23. 选择题 | 详细信息 |
|
下列物质的用途不正确的是( ) A. 硅是制造光导纤维的材料 B. 硅是制造太阳能电池的常用材料 C. 二氧化硅是制取粗硅的原料 D. 水玻璃可用作木材防火剂 |
|
| 24. 选择题 | 详细信息 |
|
实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( ) A. 950mL,111.2g B. 500mL,117g C. 1000mL,l17g D. 任意规格,117g |
|
| 25. 选择题 | 详细信息 |
|
浓硝酸常呈黄色的原因是( ) A.浓硝酸中混有碘化银 B.浓硝酸中混有铁离子 C.浓硝酸易分解产生二氧化氮 D.浓硝酸中混有单质硫 |
|
| 26. 选择题 | 详细信息 |
|
下列关于氨的说法正确的是 ( ) A.氨气是无色无味的气体 B.氨气极易溶于水 C.可用向上排空气法收集 D.液氨和氨水是同一物质 |
|
| 27. 实验题 | 详细信息 |
|
工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。 工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:  (1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱 (2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。 (3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________ . |
|
| 28. 实验题 | 详细信息 |
|
结合氯气的相关知识解决下列问题。 (1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。 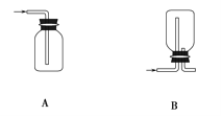 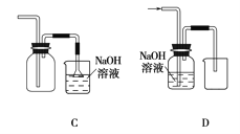 漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同。 漂白粉与稀盐酸发生复分解反应,化学方程式为_________________________。漂白粉与浓盐酸发生氧化还原反应,化学方程式为____________________________________。 (2)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。  ①能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。 ②c过程中的现象是________________。 |
|
| 29. 实验题 | 详细信息 |
如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答: (1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。 (2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。 |
|
| 30. 实验题 | 详细信息 |
某学习小组利用下列装置探究氯气与氨气的反应.其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.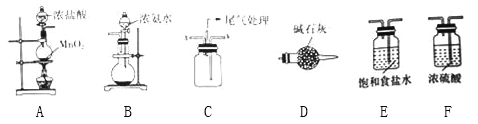 (1)若Cl2从左向右流动,NH3从右向左流动,则上述实验装置中,依次连接的合理顺序为:A→________________→B;为使NH3与Cl2更充分混合,Cl2应从C装置的__口进入(填“x”或“y”). (2)简述装置A中使用分液漏斗向圆底烧瓶中滴加浓盐酸的操作是__________________. (3)装置A中发生反应的离子方程式为_______________________________. (4)装置B中圆底烧瓶内的试剂为______________(填名称). (5)装置D的作用是____________________________. (6)反应开始后,装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中的主要成分之一,该反应的化学方程式为________________________________ |
|
| 31. 推断题 | 详细信息 |
已知A→C必须加热,否则会发生钝化现象。请回答下列问题: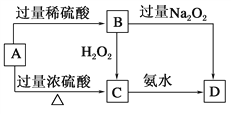 (1)A是________,你推断的理由是___________________。 (2)B在酸性条件下与H2O2反应的离子方程式:_____________________。 (3)A与过量浓H2SO4反应的化学方程式:_______________________。 |
|
| 32. 推断题 | 详细信息 |
根据下图所示的转化关系,回答下列问题: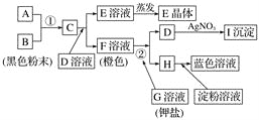 (1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。 (2)推出下列物质的化学式:E____________;I______________。 (3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。 |
|
最近更新



