高三化学上册专题练习考试完整版
| 1. 选择题 | 详细信息 |
|
下列实验过程中,始终无明显现象的是 A. B. C. D. |
|
| 2. 选择题 | 详细信息 |
|
同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl;②NO2;③体积比为4:1的NO2和O2,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为( ) A.1:1:1 B.4:4:5 C.5:5:4 D.15:10:12 |
|
| 3. 选择题 | 详细信息 | ||||||
由下述实验所得的结论不正确的是
|
|||||||
| 4. 选择题 | 详细信息 |
用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。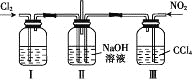 下列叙述正确的是 A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气 B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气 C. 装置Ⅲ的作用是便于控制通入NO2的量 D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO |
|
| 5. 选择题 | 详细信息 |
如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是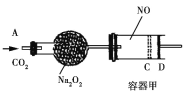 A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况) B. NO2转化为N2O4的转化率为20% C. 容器甲中NO已反应完 D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01 |
|
| 6. 选择题 | 详细信息 |
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为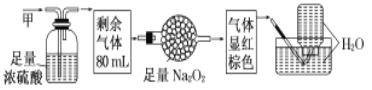 A.NO2、NH3、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NH3、NO、N2 |
|
| 7. 选择题 | 详细信息 |
|
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是 A.此反应过程中转移的电子为0.6mol B.消耗氧气的体积是1.68L C.混合气体中含NO23.36L D.参加反应的硝酸是0.5mol |
|
| 8. 选择题 | 详细信息 |
|
把xmlCO2通过足量的Na2O2后再与ymLNO混合。x与y之和为30mL。设充分反应后气体的体积缩小为15mL, 则x:y为以下哪个答案( )(忽略NO2与N2O4的转化) ①1:1 ②2:1 ③5:4 ④7:5 A. 只有① B. 只有② C. 只有③④ D. ①②③④ |
|
| 9. 选择题 | 详细信息 |
Cu 与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH 溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示: 下列有关判断正确的是 A.若铜片为51.2 g,则生成0.2 mol NaNO3 B.常温下,Cu 遇浓硝酸发生钝化,不可能发生上述反应 C.标准状况下收集的氮氧化物为20.16 L D.反应过程中生成的Cu(NO3)2既是氧化产物,也是还原产物 |
|
| 10. 选择题 | 详细信息 |
|
硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的尾气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是 A.在用氨气处理氮氧化物时,氮氧化物发生还原反应 B.所得溶液中NaNO3和NaNO2的物质的量之比可能为2:1 C.若用氨气处理,所需氨气在标准状况下的体积可能为39.2L D.原混合气体中NO在标准状况下的体积可能为16.8L |
|
| 11. 选择题 | 详细信息 |
|
将amol铁粉加入到含bmol硝酸溶液中,充分反应后铁粉完全溶解,共收集到c L(标况)的NO、NO2混合气体。下列有关说法不正确的是 A. 若反应后产物中只有Fe2+生成,则 B. 若反应后产物中只有Fe3+生成,则b=3a + C. 若反应后产物中有Fe2+、Fe3+生成,则 D. 若反应后溶液中有dmol H+,则b=3a+d+ |
|
| 12. 选择题 | 详细信息 |
|
有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为( ) A. 1∶4 B. 2∶3 C. 1∶3 D. 4∶1 |
|
| 13. 选择题 | 详细信息 |
|
三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4:l的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( ) A.①和③试管内溶液体积不等,溶质物质的量浓度也不相等 B.因为它们都可溶于水,所以液面都上升到试管顶部 C.三支试管中,试管②中溶液中溶质的物质的量浓度最小 D.试管②和试管③中溶液的溶质的物质的量浓度一定相等 |
|
| 14. 选择题 | 详细信息 |
|
汽车尾气中含有NO2、NO和CO等有害气体,现取标准状况下22.4 L汽车尾气,研究发现该气体通过催化转化器后,上述三种有害气体可被完全转化为无害的N2和CO2,再取等体积尾气通入0.1 mol/L 50 mL NaOH溶液中,其中的NO2和NO恰好被完全吸收。则尾气中CO的体积分数可能为(说明:汽车尾气中其它成分气体与CO和NaOH溶液均不反应)( ) A. 0.4% B. 0.8% C. 2% D. 4% |
|
| 15. 选择题 | 详细信息 |
|
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2②NO2和O2③NH3和 A. |
|
| 16. 选择题 | 详细信息 |
|
下列实验过程中,始终无明显现象的是 A. B. C. D. |
|
| 17. 选择题 | 详细信息 |
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入少量氧气后,可以观察到试管内水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体是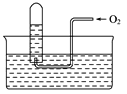 A. 可能是N2与NO2的混合气体 B. 只能是O2与NO2的混合气体 C. 可能是NO与NO2的混合气体 D. 只能是NO2一种气体 |
|
| 18. 选择题 | 详细信息 | |||||||||||||||
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。a和b分别可以是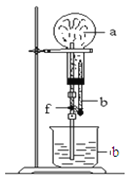
|
||||||||||||||||
| 19. 选择题 | 详细信息 |
|
将NO、NO2的混合气体缓缓通入盛有10L0.3mol/LNaOH溶液的烧杯中,恰好被完全吸收,则混合气体中NO、NO2的体积比为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O) A.≤1:1 B.只能等于1:2 C.只能等于1:1 D.等于1:3 |
|
| 20. 选择题 | 详细信息 |
|
标准状况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散) A.此反应中水既不是氧化剂又不是还原剂 B.试管内溶液中溶质的物质的量浓度为 C.溶液体积占试管容积的三分之二 D.若将试管中的气体换为氯化氢,则水充满试管 |
|
| 21. 选择题 | 详细信息 |
用如图所示装置探究Cl2和NO2在NaOH溶液中的反应,若通入适当比例的Cl2和NO2,即发生反应Cl2+2NO2+4NaOH=2NaNO3+2NaCl+2H2O。 下列叙述正确的是 A. 实验室中用二氧化锰与3 mol·L-1的盐酸共热制备氯气 B. 装置Ⅰ中盛放的试剂是浓硫酸,作用是干燥氯气 C. 装置Ⅲ的作用是便于控制通入NO2的量 D. 若制备的NO2中含有NO,应将混合气体通入水中以除去NO |
|
| 22. 选择题 | 详细信息 |
“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是 A.加热时,a上部聚集了固体NH4Cl,说明NH4C1的热稳性比较好 B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 C.加热时,c中溶液红色变深,冷却后又变浅 D.水浴时,d内气体颜色变浅,e内气体颜色加深 |
|
| 23. 选择题 | 详细信息 |
|
标准状况下,三个烧瓶分别盛①等体积的NH3和N2的混合气、②等体积的NO2与O2的混合气、③纯净的NO2气体,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为 A.5:4:5 B.1:1:1 C.15:10:12 D.无法计算 |
|
| 24. 选择题 | 详细信息 |
|
NO、NO2、O2按照一定比例通入水中能被完全吸收,无剩余气体。若NO、NO2、O2的气体体积分别为x、y、z,则x:y:z不可能为( ) A.1:1:1 B.6:2:5 C.3:6:4 D.2:6:3 |
|
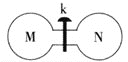
| 25. 选择题 | 详细信息 | |||||||||||||||||
常温下,向如图所示的两个容积相同的刚性容器中分别充入气体M、N(如表所示),使两容器中压强相等。打开开关k,两容器中的气体充分混合后,恢复至常温,容器内的气体压强(固体影响忽略不计)由大到小的顺序正确的是 ( )
|
||||||||||||||||||
| 26. 选择题 | 详细信息 |
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( ) A.NO2、NH3、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2 |
|
| 27. 选择题 | 详细信息 |
|
将16mLNO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3 ①3:1 ②3:2 ③3:3 ④3:4 ⑤3:5 A.①② B.①⑤ C.②③④ D.④⑤ |
|
| 28. 综合题 | 详细信息 |
|
(1)臭氧可用于烟气脱硝。O3氧化NO结合水洗,可产生HNO3和O2,该反应的化学方程式为_________________________。 (2)如图是用NH3脱除烟气中NO的原理。  ①该脱硝原理中,NO最终转化为__________(填化学式)和H2O。 ②当消耗2mLNH3和0.5molO2时,除去的NO在标准状况下的体积为________L。 (3)用碱液脱硝是目前研究的课题之一。 ①将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO3)2。该工艺需控制NO和NO2物质的量之比接近1:1。若n(NO2):n(NO)>1:1,则会导致_____________;若n(NO2):n(NO)<1:1,则会导致_____________。 ②将氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到如图所示的电解槽中进行电解。写出A室NO2-发生的电极反应式:______________。 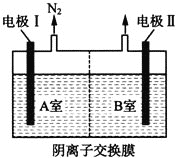 |
|
| 29. 综合题 | 详细信息 |
|
燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。 (1)用化学方程式表示NO形成硝酸型酸雨的反应______ (2)能作脱除剂的物质很多,下列说法正确的是______ a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率 c.用CO作脱除剂,会使烟气中NO2的浓度增加 (3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2 Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g) H2NCOONH4(s) ①尿素释放出NH3的热化学方程式是______。 ②写出有利于尿素释放NH3的条件并说明理由______。 ⅡCO(NH2)2与某种烟气 ①曲线a 对应CO(NH2)2 与NO的物质的量比值是______。 ②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。 ③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。 ④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______ mg/(m3·s) 。  |
|
| 30. 综合题 | 详细信息 |
|
近年来环境问题突出,大气污染更为严重。回答下面问题 (1)下列选项中属于重点城市空气质量日报首要污染物的是_____ A.CO2 B.SO2 C.可吸入颗粒物 D.H2S (2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________ (3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例) I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同) II:CO+Pt(S)=CO(S) III:NO(S)=N(S)+O(S) IV:CO(S)+O(S)=CO2+2Pt(S) V:N(S)+N(S)=N2+2Pt(S) VI:NO(S)+N(S)=N2O+2Pt(S) 尾气中反应物及生成物浓度随温度的变化关系如下图。  回答下面问题 ①汽车尾气消污反应最适宜的反应温度是____ A. 250℃ B.300℃ C.330℃ D.400℃ ②330℃以下的低温区发生的主要反应的化学方程式是___________ ③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填 “<”、“>”或“=”),理由是_______________ ④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。 |
|
| 31. 综合题 | 详细信息 |
|
SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。 (1)SCR(选择性催化还原)工作原理: 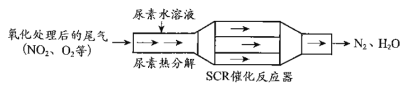 ①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式:__________________ ②反应器中NH3还原NO2的化学方程式:________________________; ③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________________________; ④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60 g·mol −1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L−1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L−1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是_________________; (2)NSR(NOx储存还原)工作原理:NOx的储存和还原在不同时段交替进行,如图a所示。 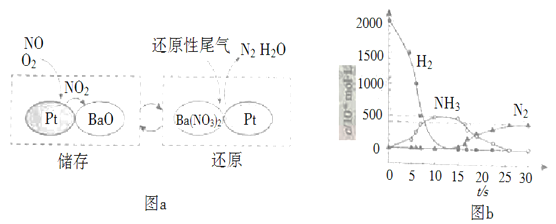 ①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。还原NOx的物质是_________________; ②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第二步反应消耗的NH3与Ba(NO3)2的物质的量之比是__________________; ③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:__________________ |
|
| 32. 实验题 | 详细信息 |
某化学课外活动小组通过实验研究NO2的性质,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O 利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。 (1)E装置中制取NO2反应的离子方程式是______。 (2)该实验中制取氨气时若只用一种试剂,从下列物质中选取______ 。 a.NH4HCO3 b.NH4Cl c.浓氨水 (3)若NO2能够被NH3还原,预期观察到C装置中的现象是______。 (4)实验过程中,未能观察到C装置中的预期现象,该小组同学从反应原理的角度分析了原因,认为可能是: ①NH3还原性较弱,不能将NO2还原; ②在此条件下,NO2的转化率极低; ③______ 。 (5)此实验装置存在一个明显的缺陷是 ______。 (6)探究NO2能否与Na2O2发生氧化还原反应,为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。  装置的合理连接顺序是 ______,实验过程中,B装置中淡黄色粉末逐 渐变成白色,经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为 ______。 |
|
最近更新