金华市高一化学2019年上学期期中考试带答案与解析
| 1. 选择题 | 详细信息 |
|
下列各组物质,均属于电解质的组是( ) A.盐酸、生石灰、苛性钠 B.氯化钠、硫酸、硫酸钡 C.熔融氧化钙、水银、食盐 D.干冰、氨气、纯碱 |
|
| 2. 选择题 | 详细信息 |
|
某原子核外电子排布为:L层电子数是K层和M层电子数之和的两倍。则该元素是( ) A.钠 B.镁 C.氖 D.氯 |
|
| 3. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.冰醋酸、酒精、氨水、苯等均不能导电 B.氢氧化铁胶体具有吸附性,因而常用于自来水的杀菌消毒 C.胶体区别于其他分散系的本质特征是否能发生丁达尔效应 D.装碘的试剂瓶中残留的碘可以用酒精洗涤 |
|
| 4. 选择题 | 详细信息 |
|
相同条件下,ag的A气体与bg的B气体占有相同体积。下列叙述错误的是 ( ) A. a∶b等于A与B的相对分子质量之比 B. a∶b等于等质量的A与B的分子数之比 C. a∶b等于同温同压下A与B的密度之比 D. b∶a等于同温同体积等质量的A与B的压强比 |
|
| 5. 选择题 | 详细信息 |
|
下列结构示意图所代表的原子或离子,在化学反应中易被氧化的是( ) A.  B. B.  C. 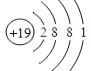 D. D. 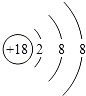 |
|
| 6. 选择题 | 详细信息 |
|
实验室用NaCl固体配500mL 1.0mol·L-1NaCl溶液,下列判断错误的是 A. 用托盘天平称取NaCl固体29.25g B. 应选用500mL的容量瓶来配制此溶液 C. 在转移操作中不慎将溶液洒到容量瓶外面,应该重新配制溶液 D. 加蒸馏水至离刻度线1-2cm时改用胶头滴管定容 |
|
| 7. 选择题 | 详细信息 |
|
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束后,所剩余的固体中有铁存在,则反应后溶液中存在较多的阳离子是( ) A.Cu2+ B.Fe3+ C.Fe2+ D.H+ |
|
| 8. 选择题 | 详细信息 |
|
下列说法中正确的是 A.地球上99%溴蕴藏在大海中,故溴被称为“海洋元素” B.提出原子结构型的科学家按时间先后排列为:道尔顿、卢瑟福、汤姆生、玻尔 C.硅晶体可以制备光导纤维 D.水泥、石英玻璃、陶瓷都是硅酸盐制品 |
|
| 9. 选择题 | 详细信息 |
|
下列关于碳酸钠和碳酸氢钠的叙述,正确的是( ) A.物质的量相同时,分别与足量的盐酸反应,生成CO2的质量:碳酸钠<碳酸氢钠 B.热稳定性:碳酸钠<碳酸氢钠 C.质量相同时,分别与同体积同浓度盐酸反应的快慢:碳酸钠>碳酸氢钠 D.常温时,在水中的溶解性:碳酸钠>碳酸氢钠 |
|
| 10. 选择题 | 详细信息 |
|
工业上制造镁粉是将镁蒸气在气体中冷却。可作为冷却气体的是 ①空气 ②CO2 ③Ar ④H2 ⑤N2 A. ①② B. ②③ C. ③④ D. ④⑤ |
|
| 11. 选择题 | 详细信息 |
|
下列各组离子能在酸性的无色溶液中大量共存的是( ) A.K+、Na+、SO42-、MnO4- B.Mg2+、Cl-、Al3+、NO3- C.NH4+、Cl-、HCO3-、NO3- D.Ca2+、Na+、Fe3+、Br- |
|
| 12. 选择题 | 详细信息 |
|
等物质的量浓度的氯化铝、氯化镁、氯化钠三种溶液的体积比为3:2:1,则三种溶液中氯离子的物质的量浓度之比为( ) A.1:2:3 B.9:4:1 C.3:2:1 D.1:1:1 |
|
| 13. | 详细信息 |
|
将足量的二氧化锰与40 mL 10 mol/L浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比( ) A. 前者产生的Cl2多 B. 后者产生的Cl2多 C. 一样多 D. 无法比较 |
|
| 14. 选择题 | 详细信息 |
|
要证明某溶液中不含Fe3+,而可能含Fe2+,进行如下实验操作时,最佳顺序是( ) ①加足量新制氯水 ②加足量KMnO4溶液 ③加少量KSCN溶液 A.①② B.③② C.①②③ D.③① |
|
| 15. 选择题 | 详细信息 | ||||||||||||||||||||
下列除杂试剂的选择和除杂操作均正确的是( )
|
|||||||||||||||||||||
| 16. 选择题 | 详细信息 | ||||||||||||||||||||
已知X、Y、Z均为中学化学常见物质,且均含有同一种元素,其中X是单质,它们之间的转化关系如图所示。则X、Y、Z不可能是( )
|
|||||||||||||||||||||
| 17. 选择题 | 详细信息 |
|
在标准状况下,如果2.8L氨气含有n个原子,则阿伏加德罗常数可表示为( ) A. |
|
| 18. 选择题 | 详细信息 |
|
有四瓶常用溶液: ①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别出来,鉴别出来的先后顺序是( ) A.①④③② B.①③④② C.①④②③ D.④①③② |
|
| 19. 选择题 | 详细信息 |
|
向amolNaOH的溶液中通入bmolCO2,下列说法不正确的是( ) A.当0.5a<b<a时,溶液中HCO3-与CO32-的物质的量之比为(a-b):(2b-a) B.当a<b时,发生的离子反应为:OH-+CO2=HCO3- C.当a>2b时,发生的离子反应为:2OH-+CO2=CO32-+H2O D.当2a=3b时,发生的离子反应为:3OH-+2CO2=CO32-+HCO3-+H2O |
|
| 20. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.常温常压下,48gO3含有的氧为3NA B.标准状况下,22.4 L水含有的水分子数为NA C.常温常压下,11.2 L氧气所含的原子数小于NA D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA |
|
| 21. 选择题 | 详细信息 |
|
BrCl的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,也可以与水发生如下反应:BrCl+H2O=HCl+HBrO,下列说法正确的是( ) A.BrCl与Ca(OH)2溶液反应,产物有CaBr2、Ca(ClO)2和H2O B.BrCl与水反应时,水既是氧化剂又是还原剂 C.BrCl与钠反应,化学方程式是2Na+BrCl=NaCl+NaBr D.BrCl与铁反应,化学方程式是2Fe+2BrCl=FeCl2+FeBr2 |
|
| 22. 选择题 | 详细信息 |
|
将2.3g钠放入91.8g水中,反应完全后,溶液中Na+与H2O分子的个数比为( ) A.1︰30 B.1︰40 C.1︰50 D.1︰51 |
|
| 23. 选择题 | 详细信息 |
|
下列离子方程式中错误的是( ) A.氯气通入碘化钾溶液中Cl2+2I-=I2+2Cl- B.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ C.醋酸跟氢氧化钾溶液反应:CH3COOH+OH-=CH3COO-+H2O D.碳酸镁跟硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
|
| 24. 选择题 | 详细信息 |
|
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( ) A.ClO2是氧化产物 B.1mol KClO3参加反应有2 mol电子转移 C.H2C2O4在反应中被还原 D.KClO3在反应中得到电子 |
|
| 25. 选择题 | 详细信息 |
|
今有一混合物水溶液,只可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是( ) A.溶液中一定存在CO32﹣、SO42﹣、Na+ B.溶液中c(Na+)≥0.6mol•L﹣1 C.溶液中一定没有Ba2+,可能存在Cl﹣ D.溶液中n(SO42﹣)≤0.02mol |
|
| 26. 填空题 | 详细信息 |
|
请回答: (1)用氧化物的形式表示翡翠:NaAl(SiO3)2的组成:___。 (2)钠与水反应的离子方程式:___。 (3)Cu与FeCl3溶液反应的离子方程式:___。 (4)写出硫酸氢钠溶于水后的电离方程式:___。 (5)碳酸氢钠在日常生活中的二个应用:___。 (6)硫酸铁溶液与硫氰化钾溶液反应的离子方程式:___。 |
|
| 27. 综合题 | 详细信息 |
为探究某矿物固体X(仅含4种短周期元素)的组成和性质,其中固体乙可制光导纤维。现设计并完成如下实验: 请回答: (1)X除了含有H、O元素以外还含有____________。 (2)固体丙的用途____________。 (3)X的化学式是____________。 (4)固体乙与NaOH溶液反应的离子方程式是____________。 |
|
| 28. 实验题 | 详细信息 |
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图: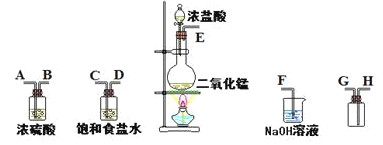 (1)连接上述仪器的正确顺序是(填各接口处的字母):E接 , 接 , 接 , 接 。___ (2)在装置中饱和食盐水起的作用是___。 (3)化学实验中检验是否有Cl2产生常用试纸为___。 (4)写出氢氧化钠溶液中反应的离子方程式___。 (5)将0.2molMnO2和500mL12mol/L盐酸混合后缓缓加热,MnO2反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀的物质的量为___(不考虑盐酸的挥发和氯气的溶解)。 (6)实验室也可以用K2Cr2O7和盐酸反应制取Cl2,配平反应方程式,并指出氧化剂和还原剂的物质的量之比是___,________K2Cr2O7+________HCl=________KCl+________CrCl3+________Cl2↑+________H2O (7)已知还原性:SO32->I-。向含amolKI和amolK2SO3的混合液中通入bmolCl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是___ A.当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- B.当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- C.当a<b< D.当a≤b≤ |
|
| 29. 实验题 | 详细信息 |
|
实验室要配制480mL0.1mol·L-1Na2CO3溶液,回答下列问题。 (1)应用托盘天平称取Na2CO3·10H2O晶体___g。 (2)配制Na2CO3溶液时需用的主要玻璃仪器有烧杯、玻璃棒、___、___。 (3)若实验遇下列情况,溶液的浓度偏低的是___ A.加水时超过刻度线 B.忘记将洗涤液加入容量瓶 C.容量瓶内壁附有水珠而未进行干燥处理 D.定容后摇匀,液面低于刻度线 E.称量时砝码生锈 |
|
| 30. 计算题 | 详细信息 | ||||||||||||||||||||
为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸60.0mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
|
|||||||||||||||||||||
最近更新



