吉林市2019年高一化学上半期期中考试在线做题
| 1. 选择题 | 详细信息 |
|
R元素的原子有三个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是 ( ) A. R元素处于第三周期ⅥA族 B. R元素是非金属元素 C. 原子核外共有14个电子 D. R元素最低化合价为-2 |
|
| 2. 选择题 | 详细信息 |
|
对于反应中的能量变化,表述正确的是 A. 放热反应中,反应物的总能量大于生成物的总能量 B. 断开化学键的过程会放出能量 C. 加热才能发生的反应一定是吸热反应 D. 氧化反应均为吸热反应 |
|
| 3. 选择题 | 详细信息 |
在如图所示的原电池中,下列说法正确的是( ) A. Zn为负极,Cu为正极 B. 正极反应为 Zn-2e-===Zn2+ C. 负极反应为Cu-2e-===Cu2+ D. 该装置能将电能转化为化学能 |
|
| 4. 选择题 | 详细信息 |
|
已知空气-锌电池的电极反应为:锌片:Zn+20H--2e-=ZnO+H20 石墨:02+2H20+4e-=40H-根据此判断,锌片是 A.负极,并被氧化 B.负极,并被还原 C.正极,并被氧化 D.正极,并被还原、 |
|
| 5. 选择题 | 详细信息 |
|
原电池总反应离子方程式为Mg+2H+===Mg2++H2↑,能实现该反应的原电池是( ) A. 正极为铜,负极为镁,电解质溶液为稀盐酸 B. 正极为铜,负极为铁,电解质溶液为稀硫酸 C. 正极为石墨,负极为镁,电解质溶液为CuSO4溶液 D. 正极为银,负极为镁,电解质溶液为NaCl溶液 |
|
| 6. 选择题 | 详细信息 |
|
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列图中表示其产生H2的总体积(V)与时间(t)的关系正确的是( ) A.  B. B.  C.  D. D. 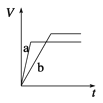 |
|
| 7. 选择题 | 详细信息 |
|
把A、B、C、D四块金属片浸泡在稀硫酸中,用导线两两连接可以组成各种原电池。A、B连接时,A 为负极;C、D连接时,电流由D到C;A、C连接时,C极产生大量气饱;B、D连接时,B极上产生大量气泡。则这4种金属的活动生顺序(由强到弱)为( ) A. A>B>C>D B. A>C>D>B C. C>A>B>D D. B>D>C>A |
|
| 8. 选择题 | 详细信息 |
|
反应4A(g)+5B(g)===4C(g)+4D(g)在0.5 L密闭容器中进行,30 s后A减少了0.90 mol,则此反应的速率可表示为( )。 A.v(A)= 0.030 mol/(L ·s) B.v(B)=0.075 mol/(L· s) C.v(C)=0.030 mol/(L· s) D.v(D)=0.030 mol/(L· s) |
|
| 9. 选择题 | 详细信息 |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( ) A. 两烧杯中溶液的pH均增大 B. 甲中铜片是正极,乙中铜片是负极 C. 两烧杯中铜片表面均无气泡产生 D. 产生气泡的速度甲比乙慢 |
|
| 10. 选择题 | 详细信息 |
|
反应A(g)+3B(g) ①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为 A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>① |
|
| 11. 选择题 | 详细信息 |
|
下列过程中化学反应速率的加快对人类有益的是( ) A. 金属的腐蚀 B. 食物的腐败 C. 塑料的老化 D. 氨的合成 |
|
| 12. 选择题 | 详细信息 |
|
对A2+3B2 A. v(AB3)=0.5mol/(L·min) B. v(B2)=0.6mol/(L·min) C. v(A2)=0.4mol/(L·min) D. v(A2)=0.3mol/(L·min) |
|
| 13. 选择题 | 详细信息 |
|
将4 molA气体和2mol B气体在2L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)═2C(g)。若经2s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( ) ①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 ③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol·L-1 A. ①③ B. ①④ C. ②③ D. ③④ |
|
| 14. 选择题 | 详细信息 |
如图所示的装置中,a是较活泼的金属,b是常温下化学性质很不活泼且能导电的碳棒。下列关于装置的叙述不正确的是( ) A. 碳棒上有气体产生 B. a是正极,b是负极 C. 导线中有电子流动,其流向为从a极到b极 D. a极上发生了氧化反应 |
|
| 15. 选择题 | 详细信息 |
|
下列装置中,电流计G中有电流通过的是( ) A.  B. B.  C. 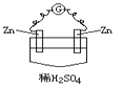 D. D.  |
|
| 16. 选择题 | 详细信息 |
|
在2 L容积不变的容器中,发生N2+3H2 A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol |
|
| 17. 选择题 | 详细信息 |
|
天然铊有两种稳定同位素 A. C. |
|
| 18. 选择题 | 详细信息 |
|
每种物质都既有离子键,又有共价键的一组物质是( ) A. NaOH、H2SO4、(NH4)2SO4 B. MgO、Na2SO4、NH4HCO3 C. Na2O2、NH4Cl、Na2SO4 D. HCl、Al2O3、MgCl2 |
|
| 19. 选择题 | 详细信息 |
|
.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( ) A. ⅢA族或ⅢB族 B. ⅣA族 C. ⅠB族 D. ⅠA族 |
|
| 20. 填空题 | 详细信息 | ||||||||||||||||||||||||||||||||||||
下表是元素周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
|
|||||||||||||||||||||||||||||||||||||
| 21. 填空题 | 详细信息 |
如图,请回答下列问题: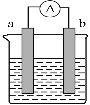 (1)若在原电池中,a电极有气泡产生,b电极逐渐变细,则该原电池的正极是___(填写字母“a”或“b”),外电路中电流流动的方向是___,b电极发生的反应类型是____(填“氧化反应”或“还原反应”)。 (2)当电极a为Zn、电极b为Ag、电解质溶液为CuSO4时,写出该原电池总的离子反应方程式:____,正极的电极反应式为____。当a极溶解的质量为6.5g时,有_____mol电子通过导线。 |
|
| 22. 填空题 | 详细信息 |
在容积为2L的密闭容器中,某可逆反应在不同反应时间各物质的量的变化情况如图所示。 (1)则该反应的的反应物是______,生成物是_____; (2)该反应的化学方程式为___________; (3)从反应开始至2分钟时,用C表示其反应速率为________。 |
|
最近更新



