新野县第一高级中学高一化学月考测验(2019年下学期)免费试卷
| 1. 选择题 | 详细信息 |
|
锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗(Ge与碳同主族)元素处于最高价态,铋元素(Bi与氮同主族)的价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式是( ) A. Bi3Ge3O15 B. Bi4Ge3O12 C. Bi4Ge3O16 D. Bi3Ge3O12 |
|
| 2. 选择题 | 详细信息 |
|
下列有关化学用语的表示方法中正确的是( ) A. 过氧化氢的电子式 B. NH4I的电子式: 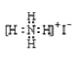 C. 比例模型 D. CO2分子的结构式:O=C=O |
|
| 3. 选择题 | 详细信息 |
|
下列条件一定能使反应速率增大的是( ) ① 增加反应物的物质的量 ② 升高温度 ③ 缩小反应容器的体积 ④ 不断分离出生成物 ⑤加入MnO2 A.全部 B.①②⑤ C.②③ D.② |
|
| 4. 选择题 | 详细信息 |
|
能说明氯的非金属性比硫强的事实是( ) A. 氯化氢的酸性强于硫化氢 B. 氯化氢的稳定性比硫化氢强 C. 氯气能与水反应而硫不能 D. 氯原子最外电子层上有7个电子而硫最外电子层上有6个电子 |
|
| 5. 选择题 | 详细信息 |
近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( ) A. M极生成氮气且电极附近溶液酸性增强 B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜 C. 正极的电极反应式为:O2+4H++4e-=2H2O D. d口流出的液体是蒸馏水 |
|
| 6. 选择题 | 详细信息 |
|
有某烷烃与烯烃的混合气体9.00g,该混合气体的密度为相同状况下氢气的11.25倍,将混合气体通过足量溴水,溴水质量增加4.20g,则原混合气体的组成为( ) A. 甲烷 、乙烯 B. 乙烷 、乙烯 C. 甲烷 、丙烯 D. 甲烷 、丁烯 |
|
| 7. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A. 质子数相同的微粒一定属于同一种元素,但不一定是同种核素 B. 原子的最外层有1-2个电子的元素都是活泼的金属元素 C. 同族元素的最外层电子数一定相同 D. 在周期表中位于同周期且同族的不同核素,不一定属于同种元素 |
|
| 8. 选择题 | 详细信息 |
|
只用一种试剂就可将己烯、甲苯、硝基苯、水、氢氧化钠溶液鉴别开,这种试剂是( ) A. 盐酸 B. 酸性高锰酸钾溶液 C. 溴水 D. 紫色石蕊溶液 |
|
| 9. 选择题 | 详细信息 |
|
已知丙烷的二氯代物有四种同分异构体,则其六氯代物的异构体数目为( ) A. 三种 B. 四种 C. 五种 D. 六种 |
|
| 10. 选择题 | 详细信息 |
电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是( )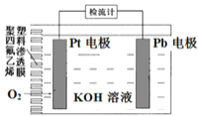 A. Pt电极上发生还原反应 B. 随着使用,电解液的碱性逐渐减弱 C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2 |
|
| 11. 选择题 | 详细信息 |
|
下列分子中所有的原子都满足最外层为8电子结构的是 A. BCl3 B. COCl2 C. SF6 D. SiH4 |
|
| 12. 选择题 | 详细信息 |
|
下列各物质中,只表示一种纯净物的是( ) A. C4H8 B. C3H8 C. C2H4C12 D. C4H6 |
|
| 13. 选择题 | 详细信息 |
|
下列判断正确的是 A. 离子化合物中不可能含有共价键 B. 晶体中一定存在化学键 C. 碱性氧化物一定是金属氧化物 D. 直径介于1~10 nm之间的微粒称为胶体 |
|
| 14. 选择题 | 详细信息 |
|
在A(g)+ pB(g) A. pm/qt mol·L-1s-1 B. mt / pq mol·L-1s-1 C. pq/mt mol·L-1s-1 D. pt/mq mol·L-1s |
|
| 15. 选择题 | 详细信息 |
|
原子序数依次增大的X、Y、Z、M、W为五种短周期元素,已知Y与Z、M与W分别同周期,X与M同主族;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76g•L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法正确的是( ) A. 由X、Y、Z三种元素形成的某种化合物,可能含有离子键 B. 五种元素分别形成的单核离子中,M的离子半径最大 C. W的氯化物是由一种10e-离子和一种18e-离子构成的 D. X元素与Z所在主族的各元素形成的A2B型化合物中X2Z沸点最低 |
|
| 16. 填空题 | 详细信息 |
|
下列各组物质中 (1)互为同分异构体的是________, (2)互为同素异形体的是________, (3)互为同位素的是________, (4)属于同一物质的是________。 ①C(CH3)4和C4H10 ② ③35Cl和37Cl ④ ⑤石墨和金刚石 ⑥  和 和⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3 ⑧H2 D2 T2 ⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3 |
|
| 17. 填空题 | 详细信息 |
|
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。 (1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案: A.比较铝和铜的硬度和熔点 B.比较二者在稀硫酸中的表现 C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性 D.分别做铝片、铜片与NaOH溶液反应的实验 E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向 上述方案中能达到实验目的的是_________________。 (2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。 (3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题: 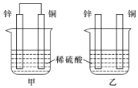 ①下列说法正确的是________ (填字母代号)。 A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化 C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱 ②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。 ③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。 |
|
| 18. 实验题 | 详细信息 |
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。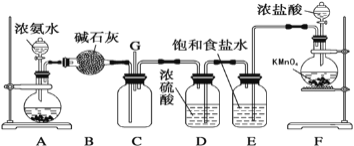 请回答下列问题: (1)装置F中发生反应的离子方程式为___________________; (2)盛放浓盐酸的装置的名称是____________;A装置中的固体可能是___________; (3)通入C装置的两根导管左边较长、右边较短,目的是_____________________; (4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:___________________________。 |
|
| 19. 综合题 | 详细信息 |
|
工业合成氨的反应为N2(g)+3H2(g) (1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。 (2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。 (3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。 (4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。 a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等 c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等 e.N2、H2和NH3的体积分数相等 f.反应达到最大程度 (5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。 |
|
| 20. 填空题 | 详细信息 |
有机物的结构可用键线式简化表示,如CH3-CH=CH-CH3可表示为 (1)X的分子式为_______________________。 (2)有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是_____________。 (3)Y在一定条件下可发生反应生成高分子化合物,该反应的化学方程式是_________________。 (4)Y可以与溴水反应,该反应的化学方程式是____________________________。 |
|
最近更新



