广西高二化学期中考试(2019年下学期)带参考答案与解析
| 1. 选择题 | 详细信息 | ||||||||||||||||||||
下表中物质的分类组合完全正确的是
|
|||||||||||||||||||||
| 2. 选择题 | 详细信息 |
|
对于可逆反应4 NH3(g)+5O2(g) A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O) B.达到化学平衡时,4v正(O2)= 5v逆(NO ) C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
|
| 3. 选择题 | 详细信息 |
|
下列表述中,与盐类水解有关的是( ) ①明矾和FeCl3可作净水剂; ②为保存FeCl3溶液,要在溶液中加少量盐酸; ③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3; ④NH4Cl与ZnCl2溶液可作焊接中的除锈剂; ⑤实验室盛放NaOH溶液的试剂瓶应用橡皮塞,而不能用玻璃塞; ⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂; ⑦草木灰与铵态氮肥不能混合施用。 A. ①②③⑤⑥⑦ B. ①②③④⑥⑦ C. ①③⑤⑥⑦ D. 全有关 |
|
| 4. 选择题 | 详细信息 |
|
下列各组离子一定能大量共存的是( ) A. 在无色溶液中: B. 在含大量 C. 在强碱性溶液中: D. 在强酸性溶液中: |
|
| 5. 选择题 | 详细信息 |
|
在2A+B A. C. |
|
| 6. 选择题 | 详细信息 |
反应:2X 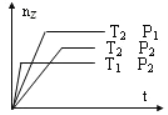 A. B. C. D. |
|
| 7. 选择题 | 详细信息 |
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是 A. a和b不连接时,铁片上会有金属铜析出 B. a 和 b 用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu C. 无论a和b是否连接,铁片均会溶解 D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动 |
|
| 8. 选择题 | 详细信息 |
|
某浓度的氨水中存在下列平衡: A. ①② B. ②③ C. ③④ D. ②④ |
|
| 9. 选择题 | 详细信息 |
下列图示与对应的叙述不相符合的是 A. 图甲表示燃料燃烧反应的能量变化 B. 图乙表示酶催化反应的反应速率随反应温度的变化 C. 图丙表示弱电解质在水中建立电离平衡的过程 D. 图丁表示强碱滴定强酸的滴定曲线 |
|
| 10. 选择题 | 详细信息 |
某同学为了使反应2HCl + 2Ag A. A B. B C. C D. D |
|
| 11. 选择题 | 详细信息 |
|
反应C(s)+H2O(g) ①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2 使体系压强增大 ④保持压强不变,充入N2使容器体积变大 A. ①④ B. ②③ C. ①③ D. ②④ |
|
| 12. 选择题 | 详细信息 |
|
甲酸的下列性质中,可以证明它是弱电解质的是 A. 0.1mol/L甲酸溶液的c(H+)=10-3mol/L B. 甲酸以任意比与水互溶 C. 10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 甲酸溶液的导电性比一元强酸溶液的弱 |
|
| 13. 选择题 | 详细信息 |
|
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g) A. 反应速率v(B)=0.25 mol·L-1·min-1 B. 该反应方程式中x=1 C. 2min时,A的物质的量为1.5mol D. 2min时,A的转化率为60% |
|
| 14. 选择题 | 详细信息 |
电动汽车已逐渐走入人们的生活,一些电动汽车动力使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料。隔膜只允许特定的离子通过,电池反应式为LixC6+Li1−xCoO2 A. 该隔膜只允许Li+通过,放电时Li+从左边移向右边 B. 充电时,B电极与电源正极相连 C. 电池放电时,负极的电极反应式为LixC6−xe− D. 废旧钴酸锂电池进行“放电处理”让Li+进入石墨中而有利于回收 |
|
| 15. 选择题 | 详细信息 |
25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是 A. HX的电离方程式为HX B. b点时溶液中c( C. HX的电离平衡常数约为1×10−7 mol/L D. a、b两点对应溶液中存在的微粒种类数目相同 |
|
| 16. 综合题 | 详细信息 |
|
Ⅰ.下图为氢氧燃料电池原理示意图,按下图的提示,回答以下问题: (1)若电解质溶液为KOH溶液,则写出电极反应式: (2)若电解质溶液为稀H2SO4,则写出电极反应式: 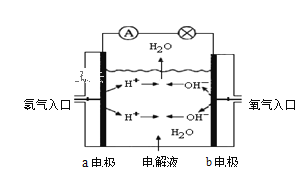 Ⅱ.氨基甲酸铵分解反应为NH2COONH4(s) A.密闭容器中氨气的体积分数不变 B.1molNH2COONH4分解同时有44gCO2消耗 C.密闭容器中混合气体的密度不变 D. |
|
| 17. 填空题 | 详细信息 |
|
在常温下,有下列五种溶液: ①0.1mol/LNH4Cl ②0.1mol/L CH3COONH4 ③0.1mol/L NH4HSO4 ④0.1mol/L NH4HCO3 ⑤0.1mol/L NaHCO3 请根据要求填写下列空白: (1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示) (2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示) (3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”) (4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”) |
|
| 18. 综合题 | 详细信息 |
|
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾. (1) SO2和NOx在空气中存在下列平衡: 2NO(g)+O2(g) 2SO2(g)+O2(g) SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。 ①写出NO2和SO2反应的热化学方程式为________________________________________。 ②随温度升高,该反应化学平衡常数变化趋势是______(填“增大”、“减小”、“不变”或“不能确定”)。 (2)工业上利用氯碱工业产品治理含二氧化硫的废气如图是氯碱工业中电解饱和食盐水的原理示意图 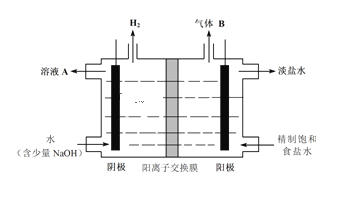 ①电解饱和食盐水的化学方程式是_______________________________________________。 ②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是_______________________。 ③用含气体B溶液吸收含二氧化硫的废气,其反应的离子方程式是__________________。 |
|
| 19. 综合题 | 详细信息 |
氧化钪(Sc2O3)在合金、电光源、催化剂、激活剂和陶瓷等领域有广泛的应用,利用钪精矿为原料(主要成分为Sc2O3,还含有Fe2O3、MnO等杂质)生产氧化钪的一种工艺流程如下: (1)“酸溶”步骤中,钪的浸出率结果如图所示。由图可知,为使钪的浸出率达90%左右,所采用的生产条件为___________________。  (2)加入氨水调节pH=3,过滤,滤渣主要成分是_____________;若再向滤液加入氨水调节pH=6,滤液中 Sc3+能否沉淀完全(离子浓度小于10−5 mol/L)?______________(列式计算并作判断)。(25℃时,Ksp[Mn(OH)2]=1.9×10−13、Ksp[Fe(OH)3]=2.6×10−39,Ksp[Sc(OH)3]=9.0×10−31) (3)已知钪与铝类似,其氢氧化物具有两性。反萃取步骤中,加入NaOH使溶液呈碱性,碱性条件下双氧水可以氧化锰离子生成滤渣,写出该反应的离子方程式______________。 (4)“沉钪”前先加入稀盐酸调节溶液至酸性,然后用草酸“沉钪”。25℃时pH=2的草酸溶液中 (5)草酸钪“灼烧”的化学方程式为_______________________。 |
|
| 20. 综合题 | 详细信息 |
|
辉铜矿(主要成分是Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题: Ⅰ.已知:①2Cu2S(s)+3O2(g) ②Cu2S(s)+O2(g) (1)Cu2S与Cu2O反应生成Cu 和SO2 的热化学方程式为____________,该反应中Cu2O作_________(填“氧化剂”或“还原剂”)。 Ⅱ.Cu2O可催化二甲醚合成乙醇。 反应①:CH3OCH3(g)+CO(g) 反应②:CH3COOCH3(g)+2H2(g) (2)压强为p kPa时,同一体系中发生反应①和反应②,温度对二甲醚(CH3OCH3)和乙酸甲酯(CH3COOCH3)平衡转化率的影响如图1所示,则ΔH1______0(填“>”或“<”,下同)、ΔH2______0。温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300~600 K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是____________。  (3)若压强为p kPa、温度为800 K时,向2 L恒容密闭容器中充入1 mol CH3OCH3 和1 mol CO发生反应①,2 min时达到平衡,则前2 min内CH3COOCH3 的平均生成速率为_________,该条件下平衡常数K=_____________。 |
|
最近更新



