四川省绵阳市南山中学2021届高三下期开学考试理科综合化学试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
化学与生活紧密相关,下列描述正确的是 A.“客从南溟来,遗我泉客珠。”其中“珍珠”的主要成分属于有机高分子化合物。 B.A1(OH)3用作塑料的阻燃剂因为其受热分解时要吸收大量热量 C.乳酸( D.水泥是由石灰石、石英砂、纯碱为原料烧制而成的 |
|
| 2. 选择题 | 详细信息 |
|
NA 代表阿伏加德罗常数的值。下列说法不正确的是 A.在1L 0.1 mol/L的Na2CO3溶液中,阴离子总数小于0.1 NA B.常温常压下,2.0gD2O中含有的质子数和中子数均为NA个 C.1 mol Fe完全溶于一定浓度的 硝酸,电子转移数可能是2 NA D.14.0 g Fe发生吸氧腐蚀生成Fe2O3•xH2O,电极反应转移的电子数为0.5 NA |
|
| 3. 选择题 | 详细信息 |
下列说法错误的是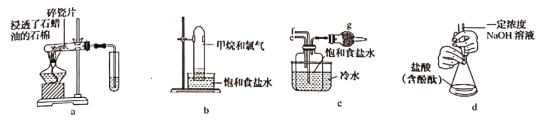 A.图a所示实验中,石蜡油发生分解反应,碎瓷片作催化剂 B.图b所示实验结束后,饱和食盐水略显浑浊 C.图c所示装置制备碳酸氢钠固体,从e口通入NH3,再从f口通CO2, g中放蘸有稀硫酸的脱脂棉 D.用图d所示装置测定某盐酸的物质的量浓度 |
|
| 4. 选择题 | 详细信息 |
某有机化合物(结构如图)是一种重要的材料中间体,下列有关该化合物的说法中不正确的是 A.分子式为C10H10O6 B.能与CH3COOH、NaHCO3、 NaOH、Na反应 C.分子中环上的碳原子不可能位于同一平面 D.与该分子式相同的有机物可能是芳香族化合物 |
|
| 5. 选择题 | 详细信息 |
二氧化氯是一种新型消毒剂,以氯酸钠为原料采用电解法制备二氧化氯装置如图所示。下列说法不正确的是 A.电极B的材料是石墨 B.阴极区部分C1O2循环反应 C.产生C1O2的反应式为C1O D.电解后阳极区溶液pH增大 |
|
| 6. 选择题 | 详细信息 |
|
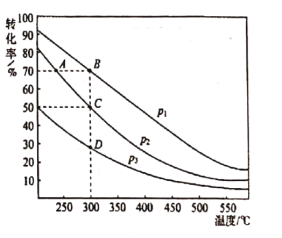
W、N、X、 Y、Z是原子序数依次增大的短周期主族元素,W的电子层数等于原子序数,X与W形成化合物常温下呈液态,N最外层有3个电子,N与W和Y形成的化合物M是有机化学工业重要的还原剂,Y是同周期中原子半径最大的元素,它与Z形成的化合物可作调味品。下列说法正确的是 A.简单离子半径: Y>Z>X B.Z的氧化物的水化物一定是强酸 C.M与水反应时,氧化产物和还原产物是同种物质 D.X与Z两元素不可能形成各原子均达8e-稳定结构的化合物 |
|
| 7. 选择题 | 详细信息 |
常温下,己知醋酸的电离常数为1.75×10-5,向20 mL 0.01mol•L-l CH3COOH溶液中逐滴加入0.01 molL-l的NaOH溶液,溶液中水电离的c(H+)随加入NaOH溶液的体积变化如图所示,下列说法不正确的是(已知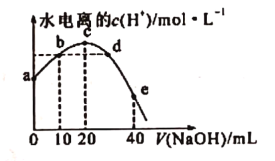 A.b、d两点溶液的pH不相同 B.a点坐标为(0,2.4×10 -11) C.b点溶液中离子浓度大小顺序是:c(CH3COO- )> c(Na+)>c(H+)>c(OH- ) D.e点所示溶液中,c(Na+)=2[c(CH3COO-)+c(CH3COOH)]=0.005 mol•L- 1 |
|
| 8. 实验题 | 详细信息 | ||||||||
某同学设计了如下装置用于制取SO2和验证SO2的性质。回答下列问题: (1)仪器a的名称为______________ (2)下列试剂不能用于吸收尾气的是________ (填序号) a.饱和Na2SO4溶液 b.饱和Na2CO3溶液 c.浓NH3·H2O d.饱和NaCl溶液 (3)实验时观察到装置B无明显现象,装置C红色褪去,则使品红的水溶液褪色的微粒一定不是_____。 (4)转置D目的是检验SO2的_____性,观察到的现象是________________。 (5)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如下实验:  实验中A、B、C烧杯中观察到的现象如下表
①煮沸的目的是___________,据A中现象得出的结论是___________ |
|||||||||
| 9. | 详细信息 |
酸性锌锰干电池是一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2和NH4Cl等组成的糊状填充物。该电池放电反应为:Zn+2NH4C1 +2MnO2= Zn(NH3)2Cl2+2MnOOH现以该废电池制备高锰酸钾的流程如下: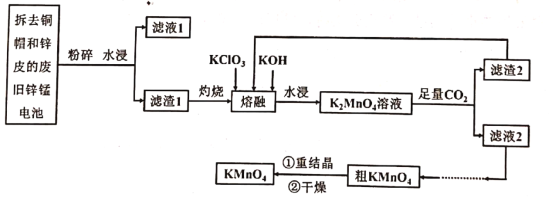 (1)滤液1的主要成份是___________, 灼烧的目的是除去___________(填名称)并使MnOOH转化为MnO2; (2)熔融时发生反应的化学方程式为___________,K2MnO4溶液中通入足量CO2反应的离子方程式____________。 (3)已知:物质的溶解度曲线如图所示,滤液2得粗KMnO4操作是___________、___________。  (4)干燥KMnO4晶体时温度不宜过高的理由是___________。 (5)称取a g上述制得的KMnO4晶体(不含有与草酸反应的杂质),配成100mL溶液,移取25.00 mL该溶液于惟形瓶,用硫酸酸化,再用b mol•L-1 H2C2O4溶液滴定,三次平均消耗H2C2O4溶液体积为c mL,滴定终点的现象是___________,则KMnO4晶体的纯度为___________ (写表达式即可) |
|
| 10. | 详细信息 | ||||||||||||||||
|
二氧化碳的资源化利用是化学研究的重要课题。我国科研人员利用直接电解装置将二氧化碳转化成液态甲酸,然后将甲酸通过合适的催化剂进行选择性制氢,获得清洁能源。 (1)甲酸选择性制氢反应为HCOOH(g)=CO2(g)+H2O(g) ∆H,相关物质的燃烧热及汽化热数据如下表所示:
则△H=___________
已知: H2的选择性是指发生反应的HCOOH中转化为H2的HCOOH所占的百分比。则CO的分压P(CO)数值为___________,选择性制氢反应的平衡常数Kp=___________。(书写计算式) |
|||||||||||||||||
| 11. | 详细信息 |
|
过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。 (1)基态钛原子和铜原子最外层电子数之比为______________。 (2)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]2+。已如S2Cl2的分子结构与H2O2相似,第一电离能(I1):I1(O)_____I1(S)(填“大于或“小于”), 原因是______;沸点:H2O2____S2Cl2(填“>”或“<”),其原因是_____。 (3)超细铜粉可用作导电材料、催化剂等,制备方法如下:  ①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为_______, 不同之处为_____(填标号) A.中心原子的杂化轨道类型 B.中心原子的孤电子对数 C.立体结构 D.VSEPR模型 ②与[Cu(NH3)4]SO4外界离子互为等电子体的微粒是_______________(任写一种) (4)ZnS在荧光体、光导体材料、涂料、酸料等行业中应用广泛。立方ZnS晶体结构如图所示,  a为S2−,b为Zn2+,其晶胞边长为apm,则晶体的密度为______________g∙cm−3[Mr(ZnS)=97,用含NA和a的代数式表示]。 |
|
| 12. | 详细信息 |
有机化合物 J在化工和医药方面有重要的应用,其合成路线如下: 已知信息:①C能发生银镜反应,E的相对分子质量比D大4, G的苯环上的一溴代物只有两种 ② 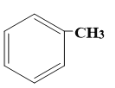  ③2RCH2CHO  请回答下列问题: (1)A的名称是_____________,H含有的官能团结构简式是_________。 (2)D→E的反应类型是___________。 (3)C与新制氢氧化铜碱性悬浊液反应的化学方程式是________________。 (4)E+I→J的化学反应方程式_______________________。 (5)符合下列要求的C8H10O的同分异构体有_________种,①芳香族化合物;②遇FeCl3溶液星紫色,其中核磁共振氢谱为4组峰,且面积比为6:2:1的任一种分子的结构简式是___。 (6)参照已知信息和合成路线,设计一条由CH2=CH2为原料合成CH3CH2CH2CH2OH的路线(注明反应条件)_______________________。 |
|

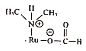 的浓度对选择性制氢反应总反应速率影响最大,则选择性制氢反应的三步反应中,活化能最大的反应是___________(填“①”②"或“③)。
的浓度对选择性制氢反应总反应速率影响最大,则选择性制氢反应的三步反应中,活化能最大的反应是___________(填“①”②"或“③)。