江苏省南京市第十三中学2021届高三上册教学质量调研化学题带参考答案
| 1. 选择题 | 详细信息 |
|
利用蛋白质的变性可以破坏病毒中的蛋白质结构,从而起到杀灭病毒的作用。下列溶液不能使蛋白质变性的是( ) A.双氧水 B.75%的酒精 C.(NH4)2SO4饱和溶液 D.NaClO浓溶液 |
|
| 2. 选择题 | 详细信息 |
|
下列有关化学用语表示正确的是( ) A.NH4Cl的电子式: B.3-甲基丁烷:  C.基态N原子的轨道表示式:  D.HCO |
|
| 3. 选择题 | 详细信息 |
|
制备(NH4)2Fe(SO4)2·6H2O晶体的实验中,对晶体析出并过滤所得的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后溶液中主要存在的一组离子正确的是( ) A.加入足量BaCl2溶液:NH B.加入足量Na2O2:Na+、NH C.加入过量稀硝酸:Fe3+、NH D.加入过量漂白粉溶液:Ca2+、Fe2+、Cl-、ClO- |
|
| 4. 选择题 | 详细信息 |
|
下列指定反应的离子方程式正确的是( ) A.向氨水中通入少量SO2:NH3·H2O+SO2=NH B.用热的NaOH溶液溶解S:3S+4OH- C.电解氯化铝溶液:2Cl-+2H2O D.向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2++HCO |
|
| 5. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是 A.NH3 B.NaClO(aq) C.CuO D.Mg2(OH)2CO3 |
|
| 6. 选择题 | 详细信息 |
|
下列物质性质与应用对应关系正确的是( ) A.氧化铝具有两性,可用于耐火材料 B.SiO2硬度大,可用于生产光导纤维 C.CaO熔点高,可用于吸收烟气中的SO2 D.钠可与水反应,可用于除去乙醚中少量的水 |
|
| 7. 选择题 | 详细信息 |
用下列实验装置进行相应实验,能达到实验目的的是( ) A.装置甲:检验乙烯的生成 B.装置乙:防止钢闸门被腐蚀 C.装置丙:证明铁发生了析氢腐蚀 D.装置丁:分离碳酸钠溶液和乙酸乙酯的混合物 |
|
| 8. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y的基态原子中含11种运动状态不同的电子, Z原子的最外层电子数与核外电子总数之比为3∶8。下列说法正确的是( ) A.原子的半径:r(X)<r(Y)<r(Z)<r(W) B.X与Y组成的化合物中均不含共价键 C.简单气态氢化物的沸点X的比Z的高 D.由X、Y、W三种元素组成的化合物的水溶液一定呈碱性 |
|
| 9. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.如图所示装置可用于铁制品表面镀铜 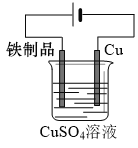 B.将2.24 LCl2溶于足量NaOH溶液中,转移0.1 mol电子 C.反应TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH>0能自发进行,其原因是ΔS>0 D.由反应2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol−1可知,CO的燃烧热为566 kJ·mol−1 |
|
| 10. 选择题 | 详细信息 |
我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法正确的是( ) 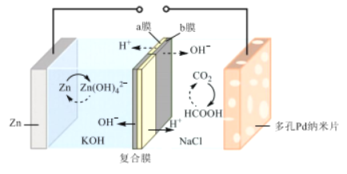 A.a膜是阴离子交换膜,b膜是阳离子交换膜 B.放电时负极的电极反应式为Zn+4OH--2e-= C.充电时多孔Pd纳米片附近pH升高 D.充电时Zn与外接直流电源正极相连,将电能转化为化学能 |
|
| 11. 选择题 | 详细信息 |
1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯(CH2=CH-CH=CH2)生成碳正离子( A.1,4-加成产物比1,2-加成产物稳定 B.1,2-加成产物的结构简式为CH3CH=CHCH2Br C.1,4-加成产物存在顺反异构现象 D.从0℃升至40℃,1,2-加成正反应速率减慢,1,4-加成正反应速率加快 |
|
| 12. 选择题 | 详细信息 |
从中草药中提取的 calebin A(结构简式如图)可用于治疗阿尔茨海默症。下列关于 calebin A的说法正确的是( ) A.能与NaHCO3溶液反应生成CO2 B.该分子中碳原子存在sp2、sp3两种杂化方式 C.1 mol该分子与溴水反应,最多消耗2 mol Br2 D.该物质性质稳定,在空气中能长时间保存 |
|
| 13. 选择题 | 详细信息 |
天然产物Z具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。下列说法正确的是( )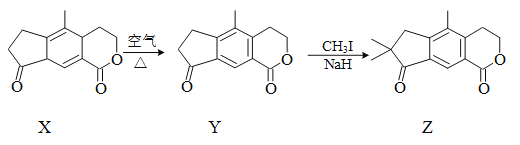 A.化合物X→Y的反应为氧化反应 B.1分子X中含有2个手性碳原子 C.可用酸性KMnO4溶液检验Y中是否混有X D.Z中所有碳原子均可能在同一平面上 |
|
| 14. 选择题 | 详细信息 | |||||||||||||||
根据下列实验操作和现象所得到的结论正确的是( )
|
||||||||||||||||
| 15. 选择题 | 详细信息 | ||||||||||||||||
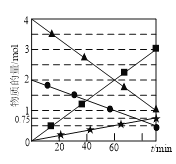
在716 K时,向容积为1 L的密闭容器中充入1 mol HI,发生反应:2HI(g)
已知该反应的正反应速率v(正)=k正·c2(HI),逆反应速率v(逆)=k逆·c(H2)·c(I2),其中k正、k逆为速率常数,大小与温度有关。下列说法正确的是( ) |
|||||||||||||||||
| 16. | 详细信息 |
|
按要求写出下列含氯物质转化的方程式。 ⑴某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。 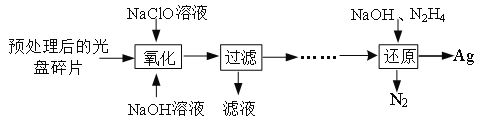 ①NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的离子方程式为____。 ②AgCl所发生“还原”反应的化学方程式为____。 ⑵Cl2O可用作氯化剂,可由Cl2与潮湿的Na2CO3反应制得,反应的产物之一为NaHCO3。该反应的化学方程式为____。 ⑶高氯酸钠是强氧化剂,可由电解NaClO3溶液制得。该反应的离子方程式为____。 ⑷如图所示为几种含氯化合物的溶解度随温度的变化曲线。常温下将其中某两种物质的饱和溶液混合,会发生反应。该反应的化学方程式为____。  |
|
| 17. | 详细信息 | ||||||||||
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备MnCO3 的工艺流程如下: 已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表:
⑴反应步骤中MnO2与BaS溶液转化为MnO的化学方程式为_____。 |
|||||||||||
| 18. | 详细信息 |
化合物D是合成降血脂药物阿伐他汀的重要中间体,其合成路线如下: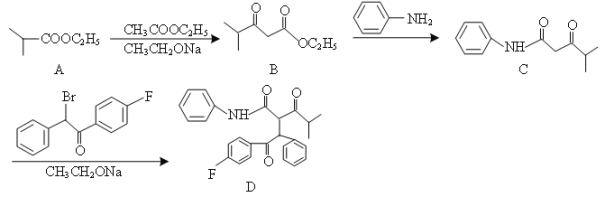 已知:  ⑴B→C的反应类型是_____。 ⑵A→B的副产物之一X是B的一种同分异构体,X的结构简式是_____。 ⑶写出同时满足下列条件的B的一种同分异构体的结构简式:_____。 ①分子中含有一个五元环,五元环中含一个氧原子; ②能使溴水褪色,能与金属钠发生反应; ③核磁共振氢谱上有三组峰,且面积比为1∶3∶3。 ⑷写出以CH3COOH、CH3CH2OH、  的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干) _____。 |
|
| 19. | 详细信息 |
|
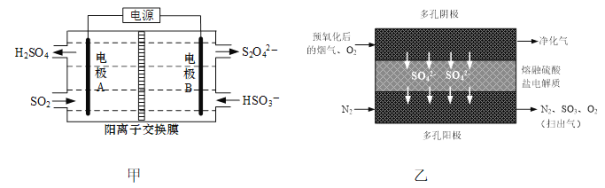
消除含氮化合物的污染是环境保护的重要研究课题。 ⑴一定条件下,某反应过程中的物质和能量变化如图所示(a、b均大于0)。 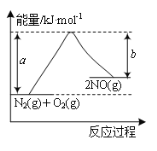 ①该反应的热化学方程式为_____。 ②2000 ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol。该温度下,若开始时向上述容器中充入的N2与O2均为1 mol,则达到平衡后N2的转化率为_____。 ⑵NO2与CO在催化剂条件下的反应为:4CO(g)+2NO2(g) A.CO2(g)和N2(g)的比例保持不变 B.恒温恒容,混合气体的颜色不再变化 C.恒温恒压,气体的体积不再变化 D.v(NO2)正=2v(N2)正 ⑶电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子将NO 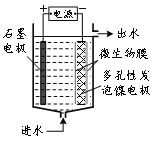 写出活性原子与NO反应的离子方程式_____。 ②若阳极生成标准状况下2.24 L气体,理论上可除去NO |
|
| 20. 填空题 | 详细信息 | ||||||||||||
|
H2S、SO2是严重危害环境的气体,多种方法可减少H2S、SO2的排放并加以资源利用。 ⑴H2S与CO2反应发生如下反应:H2S(g)+CO2(g) 相关的化学键键能数据如下表:
由此计算ΔH=_____kJ·mol-1。 |
|||||||||||||
| 21. | 详细信息 |
|
已知A、B、C、D、E、F是前四周期的核电荷数依次增大主族元素,A的最外层电子数是其电子层数的2倍,C、D同一主族,D元素原子M层有两对成对电子,E在前四周期主族元素中原子半径最大,F的基态原子中有4个未成对电子。 ⑴基态Fe2+的电子排布式是_____。 ⑵B、C、D的第一电离能由大到小的顺序是_____。(填字母对应的元素符号) ⑶BC ⑷某F的配合物化学式是[F(H2O)5Cl]Cl2·H2O,与中心F3+的形成配位键的原子或离子是_____。 ⑸F(AC)5常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。每个AC分子与F原子间均有1个配位键。 ①1 mol F(AC)5中所含σ键的数目为_____。 ②F(AC)5分子的结构可能为下图中的_____(填“甲”或“乙”),理由是_____。 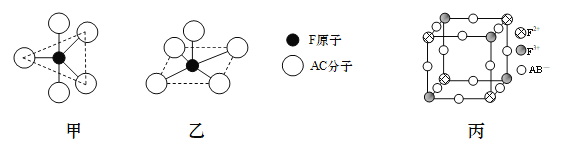 ⑹由A、B、E、F元素形成的一种蓝色晶体,其晶体结构示意图如图丙所示(图中E的离子未画出)。该蓝色晶体的化学式为_____。 |
|