上海大学附属中学高三化学下册月考试卷试卷带参考答案和解析
| 1. 选择题 | 详细信息 |
|
生活中不可将漂粉精与洁厕灵(含有盐酸)混合使用,是因为二者会反应生成( ) A.次氯酸 B.高氯酸 C.氯气 D.氧气 |
|
| 2. 选择题 | 详细信息 |
|
下列实验操作,不能用于分离物质的是( ) A.滴定 B.重结晶 C.萃取 D.纸上层析 |
|
| 3. 选择题 | 详细信息 |
|
铁是一种应用广泛的金属。下列有关铁的说法正确的是 A.铁粉与硫粉加热反应生成硫化亚铁 B.铁与盐酸反应生成氯化铁与氢气 C.铁丝在氧气中燃烧生成氧化铁 D.铁在冷的浓盐酸中会发生钝化 |
|
| 4. 选择题 | 详细信息 |
|
配制一定物质的量浓度的盐酸,必须使用的仪器是 A.锥形瓶 B.容量瓶 C.电子天平 D.漏斗 |
|
| 5. 选择题 | 详细信息 |
|
下列有关化学基本概念的判断正确的是( ) A.含有极性键的分子一定是极性分子 B.含有共价键的化合物一定是共价化合物 C.含有离子键的化合物一定是离子化合物 D.组成上相差n个CH2的分子一定是同系物 |
|
| 6. 选择题 | 详细信息 |
|
下列反应能用离子方程式H++OH-=H2O表示的是 A.HI 与 NaOH 溶液反应 B.HCl 与氨水反应 C.稀 H2SO4 与 Ba(OH)2 反应 D.CH3COOH 与 KOH 反应 |
|
| 7. 选择题 | 详细信息 |
|
SiF4与SiCl4分子都是正四面体结构。下列判断正确的是( ) A.键长:Si-F>Si-Cl B.键能:Si-F>Si-Cl C.沸点:SiF4>SiCl4 D.共用电子对偏移程度:Si-Cl>Si-F |
|
| 8. 选择题 | 详细信息 |
|
下列试剂不能用来鉴别SO2和H2S的是 A.新制氯水 B.品红溶液 C.氢氧化钠溶液 D.氢硫酸 |
|
| 9. 选择题 | 详细信息 |
|
下列物质酸性最弱的是 A.CH3COOH B.CH3CH2OH C.H2CO3 D.H2O |
|
| 10. 选择题 | 详细信息 |
|
下列各组液体的混合物,能用分液漏斗分离的是 A.四氯化碳和水 B.苯和四氯化碳 C.乙醇和苯 D.水和乙醇 |
|
| 11. 选择题 | 详细信息 |
用如图所示装置研究原电池原理。下列叙述错误的是 A.Cu棒和Zn棒用导线连接时,铜片上有气泡逸出 B.Cu棒和Zn棒不连接时,锌片上有气泡逸出 C.无论Cu棒和Zn棒是否用导线连接,装置中所涉及的总反应都相同 D.无论Cu棒和Zn棒是否用导线连接,装置都是把化学能转化为电能 |
|
| 12. 选择题 | 详细信息 |
|
将浓度和体积均相同的一元酸HA与一元碱BOH混合,所得溶液呈酸性。下列判断正确的是 A.HA一定不是弱酸 B.BOH一定不是强碱 C.HA一定是强酸 D.BOH一定是强碱 |
|
| 13. 选择题 | 详细信息 |
用如图所示装置电解氯化铜溶液。下列判断正确的是 A.Y电极为正极 B.X电极质量增加 C.Y电极表面有氯气生成 D.X电极表面发生氧化反应 |
|
| 14. 选择题 | 详细信息 |
|
将表面已完全被氧化的铝条插入下列溶液中,不会发生反应的是 A.稀硝酸 B.稀盐酸 C.氢氧化钠溶液 D.硝酸钠溶液 |
|
| 15. 选择题 | 详细信息 |
|
下列关于实验室模拟侯德榜制碱法的操作正确的是( ) A.将CO2和NH3的混合气体同时通入饱和食盐水 B.将析出的NaHCO3固体过滤洗涤后灼烧得到纯碱 C.在析出NaHCO3的母液中加入消石灰以循环利用NH3 D.在析出NaHCO3的母液中通入NH3,析出NH4Cl固体 |
|
| 16. 选择题 | 详细信息 |
已知X(g)→Z(g)的能量变化如图所示。下列判断正确的是 A.Z热稳定性高于X B.若加入催化剂,(E2-E1)变大 C.该反应为吸热反应 D.该反应的热化学方程式为X(g)→Z(g)+(E3-E1)kJ |
|
| 17. 选择题 | 详细信息 |
|
下列事实不能用化学平衡移动原理解释的是 A.新制氯水长时间放置颜色变浅 B.高压比常压更有利于 SO2 转化为 SO3 C.蒸干 AlCl3 溶液无法得到无水 AlCl3 D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率 |
|
| 18. 选择题 | 详细信息 |
|
一定温度下,某溶液 pH=7,下列判断一定正确的是 A.该溶液呈中性 B.该溶液中 c(H+)=c(OH-) C.该溶液中 c(H+)=10-7mol/L D.该溶液中 c(OH-)=10-7mol/L |
|
| 19. 选择题 | 详细信息 |
|
在0.1mol/L的碳酸氢钠溶液中滴加少量的氢氧化钠溶液,充分反应后,c(CO32-)( ) A.增大 B.减少 C.不变 D.无法确定 |
|
| 20. 选择题 | 详细信息 |
|
某沼气成分是CH4和CO2。取2L该沼气与4LO2点燃充分反应后,除去水分,剩余气体的体积为3L。该沼气中CH4和CO2的物质的量之比为(气体体积均在标准状况下测定)( ) A.1:3 B.1:1 C.3:1 D.4:1 |
|
| 21. | 详细信息 |
|
二氧化碳是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠—钙联合处理法。 第一步:用NaOH溶液吸收SO2。2NaOH+SO2→Na2SO3+H2O 第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O→CaSO3↓+2NaOH 完成下列填空: (1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是__________。 (2)氧和硫属于同族元素,该族元素的原子最外层电子排布可表示为__________。写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________ (3)NaOH的电子式为_____________。 (4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式。_____________ (5)钠—钙联合处理法的优点有__________、____________。(任写两点) |
|
| 22. 实验题 | 详细信息 |
|
碳酸氢钠是重要的化工产品。用标准盐酸溶液滴定可测定碳酸氢钠样品中碳酸氢钠含量。已知碳酸氢钠受热易分解,且在250℃~270℃分解完全。 完成下列填空: (1)测定碳酸氢钠含量的实验步骤:用电子天平称取碳酸氢钠样品(准确到_____g),加入锥形瓶中,加入使之完全溶解;加入甲基橙指示剂,用标准盐酸溶液滴定。当滴定至溶液由_____色变为_____色,半分钟不变色为滴定终点,记录读数。该实验不能用酚酞作指示剂的原因是_____。 (2)若碳酸氢钠样品质量为0.840g,用0.5000mol/L的标准盐酸溶液滴定至终点,消耗标准盐酸溶液19.50mL。样品中NaHCO3的质量分数为_____(保留3位小数)。 (3)如果滴定尖嘴部分在滴定过程中出现气泡,且滴定终点读数时气泡未消失,会导致测定结果____(选填“偏高”、“偏低”或“不受影响”)。 (4)碳酸氢钠样品含有少量水分(<0.5%)和氯化钠。以下是测定碳酸氢钠样品中水分的实验方案(样品中NaHCO3含量已知)。 ①在恒重的坩埚中称取碳酸氢钠样品,样品和坩埚的质量为m1g。 ②将样品和坩埚置于电热炉内,在250℃~270℃加热分解至完全,经恒重,样品和坩埚的质量为m2g。 ③……。 该实验方案中,质量差(m1-m2)是_____的质量。若所称取样品中NaHCO3的质量为m3g,则样品中水分的质量m=_____(用含m、m1、m2的代数式表示)。 |
|
| 23. 综合题 | 详细信息 |
|
氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。 (1)目前工业上用氮气和氢气合成氨的生产条件为________________________。 (2)如图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况。已知初始时n(N2):n(H2)=1:3。判断p1、p2的大小关系,并简述理由。 _____________________  (3)实验室在2L密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨。若反应2min,气体的总物质的量减少了0.8mol,则2min内氨气的生成速率为____________。 (4)常见氮肥有氨水、氯化铵、硫酸铵、尿素等。常温下,c(NH4+)相等的氨水、氯化铵、硫酸铵三种溶液,氨水、氯化铵、硫酸铵的浓度从大到小的关系为__________________。 (5)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因__________。 |
|
| 24. 综合题 | 详细信息 |
阿克他利M( )是一种抗风湿性关节炎药物,其合成路线如图: )是一种抗风湿性关节炎药物,其合成路线如图: 完成下列填空: (1)反应①的反应类型为_____。 (2)反应②所用的试剂为_____。 (3) (4)写出由对硝基苯乙酸( (5)A的分子式为C7H8,写出由A合成 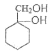 的合成路线_____。 的合成路线_____。(合成路线常用的表示方式为:A |
|
最近更新



