济宁市高二化学期末考试(2019年上册)在线免费考试
| 1. 选择题 | 详细信息 |
|
有关核外电子运动规律的描述错误的是 A. 处于最低能量的原子叫做基态原子 B. 核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释 C. 3p2表示3p能级有两个轨道 D. 在电子云示意图中,小黑点密表示电子在核外空间单位体积内出现的机率大 |
|
| 2. 选择题 | 详细信息 |
|
下列说法中正确的是 A. 所有金属元素都分布在d区和ds区 B. 元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 C. ns电子的能量不一定高于(n-1)p 电子的能量 D. 电子排布式(21Sc)1s22s22p63s23p63d3违反了洪特规则 |
|
| 3. 选择题 | 详细信息 |
|
在单质的晶体中,一定不存在的粒子是 A. 原子 B. 阴离子 C. 阳离子 D. 分子 |
|
| 4. 选择题 | 详细信息 |
|
下列分子均属于极性分子且中心原子均为sp3杂化的是 A. SO2、BF3 B. PCl3、SO3 C. CH4、SiO2 D. NF3、H2S |
|
| 5. 选择题 | 详细信息 |
|
在NH3和NH4Cl存在条件下,以活性炭为催化剂,用H2O2氧化CoCl2溶液来制备化工产品[Co(NH3)6]Cl3,下列表述正确的是 A. [Co(NH3)6]Cl3中Co的化合价是+3 B. H2O2 的电子式: C. NH3和NH4Cl化学键类型相同 D. 中子数为32,质子数为27的钴原子: |
|
| 6. 选择题 | 详细信息 |
|
下列物质的化学用语表达正确的是 A. (CH3)3COH的名称:2,2二甲基乙醇 B. 羟基的电子式: C. 甲烷的球棍模型: |
|
| 7. 选择题 | 详细信息 |
|
下列化学方程式及其对应反应类型均正确的是 A. B. 2CH3CH2OH+O2 C. CH3COOH+CH3CH2OH D. nCH2=CH2 |
|
| 8. 选择题 | 详细信息 |
在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共热,发生反应时断键的位置是 ( )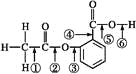 A. ①④ B. ②⑤ C. ③④ D. ②⑥ |
|
| 9. 选择题 | 详细信息 |
|
下列说法不正确的是 A. B. 反应 C. 反应 D. |
|
| 10. 选择题 | 详细信息 |
某石油化工产品X的转化关系如图,下列判断不正确的是( )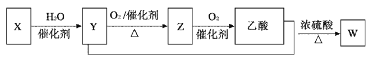 A. X可以发生加聚反应 B. Y能与钠反应产生氢气 C. Z与CH3OCH3互为同分异构体 D. W的结构简式为CH3COOC2H5 |
|
| 11. 选择题 | 详细信息 |
|
CH3+、-CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是 A. 它们互为等电子体,碳原子均采取sp2杂化 B. CH3+中的碳原子采取sp2杂化,所有原子均共面 C. CH3+与OH-形成的化合物中含有离子键 D. CH3-与NH3、H3O+互为等电子体,几何构型均为正四面体形 |
|
| 12. 选择题 | 详细信息 |
下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( ) A. y轴表示的可能是第一电离能 B. y轴表示的可能是电负性 C. y轴表示的可能是原子半径 D. y轴表示的可能是原子形成简单离子转移的电子数 |
|
| 13. 选择题 | 详细信息 |
|
短周期主族元素A、B形成AB3型分子,下列有关叙述正确的是( ) A. 若A、B为同一周期元素,则AB3分子一定为平面正三角形 B. 若AB3分子中的价电子个数为24个,则AB3分子为平面正三角形 C. 若为A、B为同一主族元素,,则AB3分子一定为三角锥形 D. 若AB3分子为三角锥形,则AB3分子一定为NH3 |
|
| 14. 选择题 | 详细信息 |
普鲁士蓝晶体结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是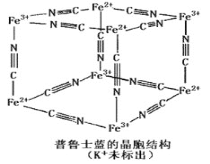 A. 化学式可以表示为KFe2(CN)6 B. 每一个立方体中平均含有24个π键 C. 普鲁士蓝不属于配位化合物 D. 每个Fe3+周围与之相邻的Fe2+离子有12个 |
|
| 15. 选择题 | 详细信息 |
|
下列有关晶体的说法中一定正确的是 ①原子晶体中只存在非极性共价键 ②稀有气体形成的晶体属于原子晶体 ③干冰晶体升华时,分子内共价键会发生断裂 ④金属元素和非金属元素形成的化合物一定是离子化合物 ⑤分子晶体的堆积均为分子密堆积 ⑥离子晶体和金属晶体中均存在阳离子,但金属晶体中却不存在离子键 ⑦金属晶体和离子晶体都能导电 A. ①③⑦ B. 只有⑥ C. ②④⑤⑦ D. ⑤⑥ |
|
| 16. 选择题 | 详细信息 |
|
分子式为C9H18O2的有机物A,在硫酸存在下与水反应生成B、C两种物质,C经一系列氧化最终可转化为B的同类物质,又知等质量的B、C的蒸气在同温同压下所占体积相同,则符合此条件的A的酯类同分异构体共有(包括A) A. 18种 B. 16种 C. 12种 D. 8种 |
|
| 17. 选择题 | 详细信息 | ||||||||||||||||||||
依据下列实验操作、现象得不到相关结论或目的的是
|
|||||||||||||||||||||
| 18. 选择题 | 详细信息 |
|
合成导电高分子材料PPV的反应 A. 合成PPV的反应为缩聚反应 B. PPV与聚苯乙烯重复结构单元不相同 C. PPV与聚苯乙烯均能使溴水反应褪色 D. 1 molPPV可以与2n molH2加成 |
|
| 19. 选择题 | 详细信息 |
|
已知酸性: A. 与稀H2SO4共热后,加入足量的NaOH溶液 B. 与稀H2SO4共热后,加入足量的Na2CO3溶液 C. 与足量的NaOH溶液共热后,再通入足量CO2 D. 与足量的NaOH溶液共热后,再加入适量H2SO4 |
|
| 20. 选择题 | 详细信息 |
我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如图: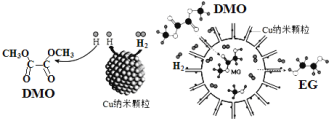 下列说法不正确的是 A. Cu纳米颗粒将氢气解离成氢原子 B. 反应过程中生成了MG和甲醇 C. EG和甲醇不是同系物 D. 1molDMO分子进行水解可以得到1 mol甲醇 |
|
| 21. 综合题 | 详细信息 |
|
请回答下列问题: (1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。 (2)BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:  晶体Q中各种微粒间的作用力有______(填序号)。 a.离子键 b.共价键 c.配位键 d.氢键 (3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。 (4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。 (5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。  图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。 |
|
| 22. 综合题 | 详细信息 |
|
根据要求填空: (1)写出有机物 (2)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为______。 (3)化学与生活息息相关。下列叙述正确的是___(填字母代号)。 A.馒头越嚼越甜 B.鲜榨橙汁遇到碘水会变蓝 C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒 (4)某化合物C3H6O2的核磁共振谱(NMR)中有3个峰,其强度比为3∶2∶1,则该化合物的结构简式可能为_______(写出一种即可)。 (5)瑞香素是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示。回答下列问题。 ①瑞香素的化学式为____,含氧官能团名称____; ②1mol此化合物可与______molBr2反应,最多可以与____molNaOH反应。 (6)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示为HCHO+2Cu(OH)2+NaOH |
|
| 23. 综合题 | 详细信息 | ||||||||||
|
含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题: (1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。 (2)化合物(CH3)3N能溶于水的原因是______。 (3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。 (4)Zn2+可与CN-、二苯硫腙( ①CN- 的结构式为_____。 ②每个二苯硫腙分子中,采取sp2杂化的原子有__个。 (5)卤化锌的熔点如表所示:
|
|||||||||||
| 24. 推断题 | 详细信息 |
吡贝地尔(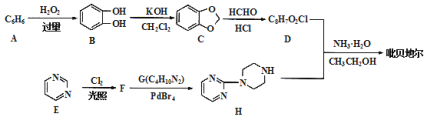 已知:① (1)A的名称是_____ (2)E→F的反应类型_______ (3)G的结构简式为______ (4)D+H→吡贝地尔反应的化学方程式为_____ (5)D的同分异构体中满足下列条件的有___种(碳碳双键上的碳原子不能连羟基),其中核磁共振氢谱有5种峰且峰面积之比为2:2:1:1:1的结构简式为____(写出一种即可)。 ①与FeCl3溶液发生显色反应; ②苯环上有3个取代基; ③1mol该同分异构体最多消耗3molNaOH(常温下,水溶液状态)。 (6)已知 |
|
高中化学 试卷推荐
最近更新




