沧源佤族自治县班洪中学九年级化学中考模拟(2019年下册)试卷带答案和解析
| 1. | 详细信息 |
|
下列物质的用途与性质不对应的是 A. 氧气助燃——金属切割 B. 氮气化学性质稳定——做保护气 C. 二氧化碳能与水反应——人工降雨 D. CO具有还原性——用作铁的冶炼 |
|
| 2. | 详细信息 |
如图是探究铁生锈条件的装置,调节L端和R端的液面高度一致,塞紧活塞,一周之后,观察现象,下列推断错误的是( )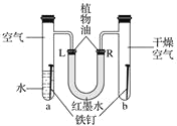 A. a管中的铁钉不生锈 B. b管中的铁钉不生锈 C. 一周后L端比R端液面高 D. 把水换成食盐水,铁生锈会更快 |
|
| 3. | 详细信息 |
如图是A、B、C三种物质的溶解度曲线。下列叙述错误的是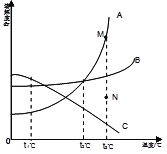 A. t1℃时,三种物质的溶解度大小顺序为A<B<C B. t2℃时,A、B两种物质的溶解度相等 C. t3℃时B的饱和溶液降温到t1℃,变成不饱和溶液 D. 若要将组成在N点的A溶液转变为M点的A溶液,可以采取恒温蒸发溶剂的方法 |
|
| 4. | 详细信息 |
|
工业上将赤铁矿炼成铁是一个复杂的过程,炼铁高炉中主要发生了下列反应(反应条件均已省略): ①C+O2═CO2 ②CO2+C═2CO ③CaCO3═CaO+CO2↑ ④Fe2O3+3CO═2Fe+3CO2 其中属于化合反应的是( ) A. ①和② B. ②和③ C. ③和④ D. ①和④ |
|
| 5. | 详细信息 |
|
人类每年从自然界中提取大量的金属铁,下列关于铁的说法不正确的是( ) A. 炼铁的过程是把生铁变成单质铁 B. 生铁和钢是铁的合金 C. 铝是地壳中含量最多的金属元素 D. 铁制品锈蚀要及时除锈 |
|
| 6. | 详细信息 |
|
下列物质间不能发生分解反应的是( ) A. 碳酸钠溶液和氯化钙溶液 B. 氢氧化钠溶液和氯化钾溶液 C. 碳酸钾溶液和盐酸 D. 硫酸铜溶液和氯化钡溶液 |
|
| 7. | 详细信息 |
向某盐酸中逐滴加入氢氧化钠溶液,所得溶液的pH与加入氢氧化钠溶液的质量关系曲线图合理的是( ) A. A B. B C. C D. D |
|
| 8. | 详细信息 |
下图是初中化学中有关甲、乙、丙、丁四种常见物质间的转化关系图,下列说法正确的是( ) A. 若甲、乙均为化合物,则丙不可能为单质 B. 若甲为碱,则该反应不一定是中和反应 C. 若该反应是氧化反应,则甲或乙一定为氧气 D. 若丁为水,则甲、乙至少有一种物质为酸或碱 |
|
| 9. | 详细信息 |
|
化学在环境保护、资源和能源利用等方面起着重要的作用,下列说法正确的是( ) A. 防止金属腐蚀是保护金属资源的唯一途径 B. 煤、石油、天然气都属于不可再生的化石燃料 C. 天然水经过沉降、过滤、吸附、消毒,得到的是纯水 D. 目前计入空气污染指数的有害气体主要包括SO2、CO2、NO2、臭氧等 |
|
| 10. | 详细信息 |
|
以下列举的事例中说法正确的是( ) A.食用馒头可以补充糖类 B.用含亚硝酸钠的工业用盐腌制食品 C.服用大量含碳酸钙的药物来补钙 D.用甲醛水溶液泡制水产品并出售 |
|
| 11. | 详细信息 |
|
氮肥能促进植物茎、叶生长旺盛,提高植物蛋白质的含量,下列化肥中属于氮肥的是( ) A. CO(NH2)2 B. Ca3(PO4)2 C. NH4H2PO4 D. K2SO4 |
|
| 12. | 详细信息 |
|
将家庭中常用的四种调味品分别放入水中,不能形成溶液的是( ) A. 醋 B. 蔗糖 C. 面粉 D. 食盐 |
|
| 13. | 详细信息 | ||||||||
某同学对所学部分化学知识归纳如下,其中有错误的一组是( )
|
|||||||||
| 14. | 详细信息 |
|
在日常生活中,下列做法错误的是( ) A. 洗涤剂具有乳化功能,常用来除去餐具上的油污 B. 聚乙烯塑料包装袋可以用加热挤压的方法封口 C. 天然气泄漏报警器应安装在灶台的上方 D. 不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上氢氧化钠溶液 |
|
| 15. | 详细信息 |
|
物质X、Y之间存在如下关系:X+2Na0H 2Y+Cu(OH)2↓,则() A.X一定是Cu(N03)2 B.X的式量比Y大 C.Y中阴离子的化合价为-2 D.该反应类型为置换反应 |
|
| 16. | 详细信息 |
|
合理开发和使用资源是人类可持续发展的前提,下列保护资源的措施中错误的是( ) A. 铁栏杆上刷一层油漆,以保护金属资源 B. 工业废水处理后循环使用,以保护水资源 C. 汽车安装尾气净化装置,以节约石油资源 D. 严禁使用一次性木筷,以保护森林资源 |
|
| 17. | 详细信息 |
|
水和以水为溶剂制成的溶液与人们的生活有着密切的关系。 (1)市售的一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,饮料温度就会降低,这种固体物质可能是________(填字母)。 A 烧碱 B 食盐 C 硝酸铵 D 生石灰 (2)如图是常见固体物质的溶解度曲线,根据图示回答: 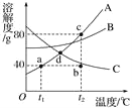 ①对A物质来说,a点的意义是________________________________________________。 ②将t1℃时,140gA的饱和溶液升温至t2℃,可用图上的________点表示。 ③t2℃时A、B、C三种物质的饱和溶液的溶质质量分数由大到小的顺序是________。 ④若将d点温度下A、B、C三种物质的饱和溶液降温至t1℃,没有晶体析出的是________物质。 (3)很多新型汽车使用铅酸蓄电池作为主要动力来源,避免了尾气的排放。某铅酸蓄电池用的酸溶液是溶质质量分数为28%的稀硫酸,若用200g溶质质量分数为98%的浓硫酸配制该稀硫酸,需要蒸馏水的质量为________g。 |
|
| 18. | 详细信息 |
|
食盐是一种重要的化工原料。请回答下列问题。 (1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。 ①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和 。 ②在蒸发过程中,待 时,停止加热,利用余热将滤液蒸干。 (2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。  ①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是 (用化学方程式表示)。 ②通过操作Ⅲ所得滤液中的溶质有 (用化学式表示)。 (3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是 。已知:20 ℃时氯化钠的溶解度为36g。 |
|
| 19. | 详细信息 |
粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2,MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题: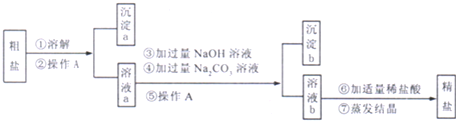 (1)实验操作A的名称是 ,该操作的目的是 . (2)写出步骤③中发生反应的主要化学方程式 ;步骤⑥的作用是 . (3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由: . |
|
| 20. | 详细信息 |
材料的应用,极大地促进了人类社会的发展和人们生活水平的提高.请从化学视角回答下列问题: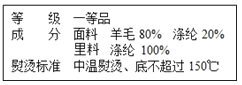 (1)如图是某品牌服装标签的部分内容.请根据标签提供的信息回答: 在面料中,属于有机合成纤维的是 .区分羊毛与涤纶的简单实验方法是 (选填“观察光泽”或“灼烧闻气味”。 (2)请列举合成橡胶在生产生活中的一种具体用途: 。 (3)塑料常用于制作食品保鲜膜及方便袋等,极大的方便了我们的生活,但大量使用后随意丢弃会造成“白色污染”。为了保护环境,减少“白色污染”,请结合日常生活提出一条合理化建立: 。 |
|
| 21. | 详细信息 |
A、B、C、D分别是氯化钠、硝酸钡、氢氧化钠和盐酸四种无色溶液中的一种,现用一种无色溶液X把A、B、C、D一一鉴别了出来,已知X是含有镁元素的化合物,鉴别方法见图所示。(所加溶液均过量,使反应完全) 完成下列问题: (1)确定A、B、C、D、X各代表什么物质(用化学式表示):A________,B________,C________,D________,X________。 (2)写出下列有关反应的化学方程式: X和B:________________________________________________________________________。 X和D:________________________________________________________________________。 |
|
| 22. | 详细信息 | ||||||||||||
小明同学想利用已有的知识弄清家里化肥的成分,他看到袋中化肥是一种白色晶体,取少量肥料跟熟石灰一起研磨,有浓烈的刺激性气味,初步判定是一种氮肥。为进一步研究肥料的性质和成分,小明将少量肥料样品带到学校进行探究。
|
|||||||||||||
| 23. | 详细信息 |
|
(1)已知金属M和N能够发生如下反应: M+H2SO4===MSO4+H2↑ Fe+MCl2===M+FeCl2 N+FeCl2===Fe+NCl2 判断Fe、M、N的活动性由强到弱的顺序是________________,以上三个化学反应均属于________(填基本反应类型)。 (2)在AgNO3、Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得滤渣和滤液: ①若滤液呈无色,则滤渣中一定含有的物质是________________(填化学式); ②若向滤渣中滴加稀盐酸,无明显现象,则滤液中所含溶质的成分可能有________种情况。 |
|
| 24. | 详细信息 | ||||||||||||||||||
|
在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有_____产生,反应的化学方程式是_____。 [发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。 [实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。  [得出结论]镁条与盐酸反应产生白色沉淀与_____有关。 [追问]白色沉淀是什么物质? [查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g; ②镁能与热水反应产生一种碱和氢气; ③氯化银既不溶于水也不溶于稀硝酸。 [做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是_____(用化学方程式表示)。 [实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
|
|||||||||||||||||||
| 25. | 详细信息 |
某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下: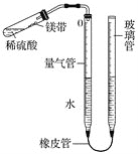 ①取一段镁带样品,准确称得其质量为0.030 g; ②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器; ③_________________________; ④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞; ⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置; ⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应; ⑦待冷却至室温后,再次记录量气管中液面位置; ⑧算出量气管中增加的气体体积为23.96 mL; 已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。 请回答下列问题: (1)写出镁与稀硫酸反应的化学方程式:____________________。 (2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。 (3)操作③是_________________________。 (4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。 (5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。 |
|
最近更新



