湖北省荆门市沙洋县沙洋中学2020-2021年高一上册10月月考化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
农夫山泉矿泉水标签上印有主要矿物质成分(单位:mg·L-1)Ca:48.00 K:39.00 Mg:3.10 Zn:0.08 Fe:0.02等,则对此矿泉水的叙述正确的是( ) A.该矿泉水不能导电 B.该矿泉水能导电 C.该矿泉水是电解质 D.该矿泉水是非电解质 |
|
| 2. 选择题 | 详细信息 |
|
下列物质在水溶液中电离方程式书写正确的是 ( ) A.Ca(OH)2 = Ca2+ + (OH-)2 B.NaHSO4 = Na++ HSO C.AlCl3 = Al+3 + 3Cl- D.Al2(SO4)3 = 2Al3+ + 3SO |
|
| 3. 选择题 | 详细信息 |
|
下列分类标准不正确的是( ) A.化学反应分为氧化还原反应、非氧化还原反应 (标准:是否有电子的转移) B.纯净物分为单质、化合物 (标准:组成物质的元素种数) C.分散系分为溶液、胶体、浊液 (标准:能否产生丁达尔效应) D.化合物分为电解质、非电解质 (标准:溶于水或熔融状态能否导电) |
|
| 4. 选择题 | 详细信息 |
|
下列离子方程式中书写正确的是( ) A.铁和稀硫酸反应:2Fe+6H+= 2Fe3++3H2↑ B.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O C.铜和硝酸银溶液反应:Cu+2Ag+=Cu2++2Ag D.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-= Mg(OH)2↓ |
|
| 5. 选择题 | 详细信息 |
|
下列叙述中,不正确的是( ) A.Cu2(OH)2CO3 属于碳酸盐 B.胆矾和干冰属于化合物,铁矿石属于混合物 C.HI、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 D.通过化学反应,可由 Ba(OH)2 一步转化生成NaOH |
|
| 6. 选择题 | 详细信息 |
|
有四瓶常用溶液:①BaCl2 溶液,②NaCl 溶液,③Na2SO4 溶液,④CuSO4 溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来。鉴别出来的先后顺序可能是( ) A.①④③② B.①④②③ C.④②③① D.④①②③ |
|
| 7. 选择题 | 详细信息 |
|
下列离子能大量共存的是 ( ) A.使无色酚酞试液呈红色的溶液中:Na+、K+、 B.无色透明的溶液中:Cu2+、K+、 C.含有大量Ba(NO3)2的溶液中:Mg2+、 D.使紫色石蕊试液呈红色的溶液中:Na+、K+、 |
|
| 8. 选择题 | 详细信息 |
|
下列分散系最不稳定的是( ) A.向水中加入食盐得到的分散系 B.向 CuSO4 溶液中加入NaOH 溶液得到的分散系 C.向沸水中滴入饱和FeCl3 溶液得到的红褐色液体 D.向 NaOH 溶液中通入SO2 得到的无色溶液 |
|
| 9. 选择题 | 详细信息 |
|
在一定条件下,RO3n-和F2可发生如下反应: A.4价 B.+5价 C.+6价 D.+7价 |
|
| 10. 选择题 | 详细信息 |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示: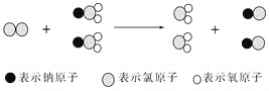 下列有关该反应的叙述正确的是( ) A.该反应是复分解反应 B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl C.反应中Cl2既是氧化剂,又是还原剂 D.生成2 个ClO2时转移的电子数为6 个 |
|
| 11. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列物质的分类正确的是( )
|
|||||||||||||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
下列四种基本反应类型与氧化还原反应的关系图中,正确的是( ) A.  B. B. C.  D. D.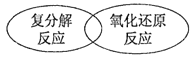 |
|
| 13. 选择题 | 详细信息 |
某兴趣小组的同学向一定体积的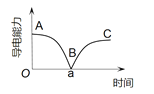 A.AB段溶液的导电能力不断减弱,说明生成的 B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C.a时刻 D.BC段溶液的导电能力不断增大,主要是由于过量的 |
|
| 14. 选择题 | 详细信息 |
|
油条的做法是将矾、碱、盐按比例加入温水中,再加入面粉搅拌成面团;放置,使面团产生气体,形成孔洞。放置过程发生反应:2KAl(SO4)2·12H2O+3Na2CO3=2Al(OH)3↓+3Na2SO4+K2SO4+3CO2↑+21H2O。下列判断正确的是( ) A.从物质的分类角度来看,油条配方中的“矾、碱、盐”主要成分均为盐 B.放置过程发生的反应为氧化还原反应 C.放置过程发生的反应中,反应物和生成物均为电解质 D.反应的离子方程式为2Al3++3 |
|
| 15. 选择题 | 详细信息 |
依据以下化学反应漫画情景进行判断,下列有关说法不正确的是( )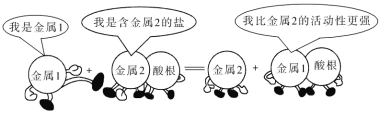 A.此反应不可能是复分解反应 B.若金属 1 是铜,则金属 2 可能是铁 C.还原性:金属 1>金属 2 D.不能确定该反应是否是氧化还原反应 |
|
| 16. 填空题 | 详细信息 |
|
填空题:已知①Cu②CO2③Fe2O3④液氨⑤盐酸⑥熔融Ba OH2⑦蔗糖⑧NaOH溶液⑨冰水混合物⑩固体CaCO3。 (1)上述物质中属于电解质的是_____(填序号,下同),属于非电解质是___,既是电解质又能导电的是_____。 (2)常温下,②⑨⑩这三种物质相互作用可生成一种新物质Ca(HCO3)2,该反应__( “是”或“不是”)氧化还原反应。 (3)写出下列反应的离子方程式 A.物质③与足量稀硫酸溶液反应的离子方程式:_____。 B.物质⑩与足量⑤溶液反应的离子方程式:_____。 C.足量的NaHCO3溶液与少量Ca OH2 的溶液反应_____。 |
|
| 17. 实验题 | 详细信息 |
为了探究 Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如图所示,充分反应后: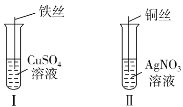 (1)Ⅰ中发生反应的离子方程式为_____; (2)Ⅱ中铜丝上观察到的现象是_____; (3)结合Ⅰ、Ⅱ实验现象可知 Fe2+ 、Cu2+ 、Ag+的氧化性由强到弱的顺序为_______。 (4)实验Ⅱ中的 AgNO3 完全反应后,抽出铜丝,洗净后干燥,称重,发现铜丝比反应前增重 0.304g,则反应生成的Ag 的质量为_____g。 |
|
| 18. 填空题 | 详细信息 |
|
Ⅰ.在工业上次磷酸(H3PO2)常用于化学镀银,发生的反应如下:Ag+ +H3PO2 +H2O →Ag↓ +H3PO4 +H+,请回答下列问题: (1)H3PO2 中,P 元素的化合价为_____;该反应中,H3PO2 被_____(填“氧化”或“还原”)。 (2)配平该离子方程:____Ag+ +_____H3PO2 +_____H2O =_____Ag↓ +_____H3PO4 +_____H+。 (3)H3PO2 是一元弱酸,写出其与足量NaOH 溶液反应的离子方程式:______ 。 Ⅱ. 现实验室用MnO2 和浓盐酸制氯气的反应为 MnO2+4HCl(浓) (4)其中被还原的元素是_____,氧化剂是_____,还原剂是_____,还原产 物是_____。 (5)用双线桥标出该反应的电子转移的方向和数目:_____。 |
|
| 19. 实验题 | 详细信息 |
|
现有甲、乙、丙三名同学分别进行 Fe(OH)3胶体的制备实验。甲同学:向 1mol·L-1的 FeCl3溶液中加少量NaOH 溶液。乙同学:直接加热饱和FeCl3溶液。丙同学:向 25 mL 沸水中逐滴加入 5~6 滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。试回答下列问题: (1)其中操作正确的同学是_____。 (2)证明有 Fe(OH)3胶体生成的实验操作是_____,利用的胶体性质是_____。 (3)已知在胶体中加入电解质溶液能使胶体粒子沉淀出来,丁同学向所制得的 Fe(OH)3胶体中加入稀硫酸,产生的现象是_____。 |
|
| 20. | 详细信息 |
|
A、B、C、D 为四种可溶性盐,它们的阳离子分别是 Ba2+、Ag+、Na+、Cu2+中的一种,阴离子分别是 NO ①把四种盐分别溶于盛有蒸馏水的四支试管中,只有 C 的溶液呈蓝色; ②向①的四支试管中分别加入盐酸,B 的溶液中有沉淀生成,D 的溶液中有无色无味的气体逸出。 根据①②实验现象回答下列问题。 (1)写出 A、B、C、D 的化学式:A_____,B_____,C_____,D_____。 (2)写出盐酸与D 反应的离子方程式:_____。 (3)写出C 与Ba(OH)2 溶液反应的离子方程式:_____。 |
|
最近更新



