南京市在线答题
| 1. 选择题 | 详细信息 |
据报道,新冠肺炎传播途径包括飞沫和气溶胶传播。在新冠肺炎防疫中普遍使用的医用外科口罩的结构如图所示。下列说法不合理的是( ) A.耳带的主要材料为聚氨酯类纤维和聚酯类纤维,这些都为合成高分子材料 B.鼻夹可以采用过胶铝条,主要体现了铝的硬度适中和延展性好 C.过滤层由于缝隙小和静电作用,可以过滤吸附气溶胶中的颗粒和病毒 D.口罩在使用后不要用手直接接触外层,要随手丢弃避免被感染 |
|
| 2. 选择题 | 详细信息 |
|
火药制备是我国古代闻名世界的化学工艺,原理为 2KNO3+S+3C=K2S+N2↑+ 3CO2 ↑。下列表示反应中相关微粒的化学用语正确的是( ) A.K+的结构示意图: B.K2S 的电子式: C.CO2 的结构式为:O=C=O D.16O2与 18O3 互为同位素 |
|
| 3. 选择题 | 详细信息 |
|
下列有关物质的性质与应用不对应的是( ) A.NH3分解生成N2和H2吸收热量,液氨可用作制冷剂 B.福尔马林能使蛋白质变性,可用于浸泡标本 C.油脂在碱性条件下易水解,可用于制作肥皂 D.ClO2具有强氧化性,可用于自来水的杀菌消毒 |
|
| 4. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中可能大量共存的是( ) A.无色透明的溶液中: Cu2+、Mg2+、 B.由水电离产生的c(H+)= 10-13mol·L-1 的溶液: K+、Na+、CH3COO-、 C.c(Fe2+)= 1mol/L的溶液中: H+、 D.pH=1的溶液中: Ba2+、Mg2+、 |
|
| 5. 选择题 | 详细信息 |
下列有关实验装置正确且能达到实验目的的是( ) A.用装置甲干燥NH3 B.用装置乙制取氯气 C.用装置丙灼烧Al(OH)3制取Al2O3 D.用装置丁分离水和溴苯 |
|
| 6. 选择题 | 详细信息 |
|
下列叙述不正确的是( ) A.植物油含不饱和脂肪酸酯,能使Br2的CCl4溶液褪色 B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 C.SO2通入到紫色石蕊试液中,溶液先变红后褪色 D.除去Mg(OH)2浊液中的Ca(OH)2,可加入足量MgCl2溶液充分搅拌后过滤 |
|
| 7. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是( ) A.红褐色固体Fe(OH)3全部溶于氢碘酸:Fe(OH)3 + 3H+=Fe3++3H2O B.水杨酸溶于NaHCO3溶液中: C.将等物质的量浓度的NaHSO4溶液与Ba(OH)2溶液等体积混合:Ba2+ + D.洁厕灵(含HCl)与84消毒液混合后产生氯气:Cl-+ H+ + ClO- = Cl2↑+OH- |
|
| 8. 选择题 | 详细信息 |
氮及其化合物的转化过程如下图所示,其中如图为反应①过程中能量变化的曲线图。 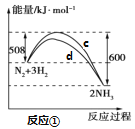 下列分析合理的是 A.如图中c曲线是加入催化剂a时的能量变化曲线 B.反应①的热化学方程式为:N2(g)+3H2(g) C.在反应②中,若有1.25 mol电子发生转移,则参加反应的NH3的体积为5.6 L D.催化剂a、b能提高化学反应①、②的化学反应速率和平衡转化率 |
|
| 9. 选择题 | 详细信息 |
|
现有短周期主族元素X、Y、Z、R的核电荷数依次增大。这四种元素组成一种化合物Q,Q具有下列性质: 下列说法错误的是( ) A.原子半径:Y>Z>X B.Y3Z4是共价化合物 C.X和Y组成的化合物在常温下都呈气态 D.最高价氧化物对应水化物酸性:Y<R |
|
| 10. 选择题 | 详细信息 |
|
下列物质转化在给定条件下能实现的是( ) A.Al(OH)3 B. C.NH3 D. |
|
| 11. 选择题 | 详细信息 |
下列有关说法不正确的是( )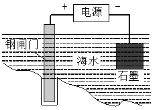 A.一定条件下反应2SO2+O2 B.用上图所示方法可保护钢闸门不被腐蚀 C.常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 D.常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应 |
|
| 12. 选择题 | 详细信息 |
由化合物X、Y在一定条件下可合成药物中间体Z。下列关于X、Y、Z的说法正确的是( )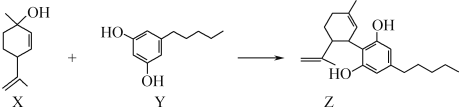 A.可用FeCl3溶液区别X与Y B.X分子中所有碳原子处于同一平面 C.X与Y分子中均不含有手性碳原子 D.Z可以使溴水褪色且1 mol Z最多消耗4mol Br2 |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
根据下列实验操作和现象所得到的结论正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是 A. 浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和: 前者大于后者 B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) D. 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COO-) > c(Cl- ) > c(CH3COOH) > c(H+) |
|
| 15. 选择题 | 详细信息 |
某研究小组以AgZSM为催化剂,在容积为1L的容器中,相同时间下测得0.1molNO转化为N2的转化率随温度变化如图所示[无CO时反应为2NO(g)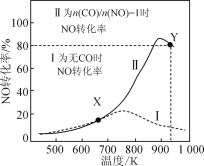 A.反应2NO B.达平衡后,其他条件不变,使 C.X点可以通过更换高效催化剂提高NO的反应速率 D.Y点再通入CO、N2各0.01mol,此时v(CO,正)<v(CO,逆) |
|
| 16. 实验题 | 详细信息 |
实验室以食盐为原料制备焦亚硫酸钠(Na2S2O5),流程如下: 已知: ① Na2SO3+SO2=Na2S2O5,5 ② 焦亚硫酸钠与强酸接触放出SO2,并生成盐。 (1)反应Ⅰ的化学方程式为__________;流程中X的化学式为________。 (2)0.5 mol Na2S2O5溶解于水配成1 L溶液,该溶液pH=4.5。 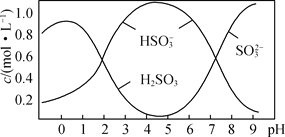 溶液中部分微粒浓度随溶液酸碱性变化如图所示,写出Na2S2O5溶于水时主要反应的离子方程式为________。 (3)若采用如图装置制取Na2S2O5。  ①要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是_________。 ②装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为__________ (填序号)。  (4) 为测定产品的纯度(假设产品中的杂质仅为Na2SO4),设计了以下实验步骤,请补充完整实验步骤:准确称取a g产品于反应容器中,加入稍过量的_________,蒸馏;将产生的___________用bmL ___________吸收,完全吸收后加水稀释得到吸收液250 mL。准确量取25.00 mL吸收液,用___________滴定,消耗c mL,计算产品纯度。 (可选用的试剂:0.5000mol·L-1酸性KMnO4溶液、2 mol·L-1的H2SO4溶液、0.1000 mol·L-1的K2C2O4溶液) |
|
| 17. | 详细信息 |
近期科研人员发现磷酸氯喹等药物对新型冠状病毒肺炎患者疗效显著。磷酸氯喹中间体N的合成路线如图: 已知:①化合物G是乙二醇,可作汽车发动机的抗冻剂 ②硝基为苯环的间位定位基(它会使第二个取代基主要进入它的间位) ③ 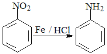 ④ 2CH3COOC2H5 请回答: (1)有机物F中的官能团名称是___________、___________。 (2)由L生成M的反应类型是___________。 (3)写出I的结构简式___________。 (4)化合物P在一定条件下可反应生成化合物Q(  ),写出同时符合下列条件的Q的同分异构体的结构简式___________。 ),写出同时符合下列条件的Q的同分异构体的结构简式___________。①1H-NMR谱检测表明,分子中共有4种氢原子; ②具有一个苯环和一个五元环,苯环上只有两个邻位的取代基。 (5)设计以化合物C和  的合成路线(用流程图表示,无机试剂任选) ___________。 的合成路线(用流程图表示,无机试剂任选) ___________。 |
|
| 18. 实验题 | 详细信息 |
|
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定: ①称取1.5680 g样品,准确配成100 mL溶液A。 ②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660g。 ③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。 (1)③中发生反应的离子方程式为___________,滴定终点的现象是___________。 (2)通过计算确定样品的组成(必须写出计算过程)。______ |
|
| 19. | 详细信息 |
|
锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。 (1)金属锰可用铝热法制得。已知Al的燃烧热为ckJ∙mol﹣1,其余相关热化学方程式为: 3MnO2(s)═ Mn3O4(s)+ O2(g)△H1= a kJ∙mol﹣1 3Mn3O4(s)+ 8Al(s)═ 9Mn(s)+ 4Al2O3(s)△H2= b kJ∙mol﹣1 则3MnO2(s)+ 4Al(s)═ 3Mn(s)+ 2Al2O3(s)△H=___________kJ∙mol﹣1(用含a、b、c的代数式表示)。 (2)MnCO3广泛用作锰盐原料。通过图1装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)⇌ 2MnO2(s)+2CO2(g)。 用真空抽气泵不断抽气的目的除保证反应持续进行外,还有___________。 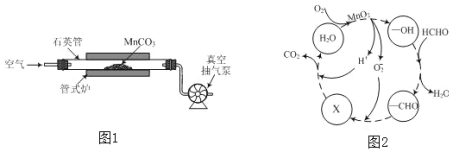 (3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图2所示,图中X表示的粒子是___________,该反应的总反应方程式为___________。 (4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:___________,电解过程中阴极附近的pH___________(选填“增大”、“减小”或“不变”)。 |
|
| 20. | 详细信息 |
|
碱式碳酸铜[2CuCO3·Cu(OH)2]可用于制造烟火等。在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成。 (1)Cu2+基态核外电子排布式为___________。 (2)Cu2+在溶液中实际上是以水合离子[Cu(H2O)4]2+的形式存在的。1mol[Cu(H2O)4]2+中含有σ键的数目_____。 (3) (4)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________。  |
|
最近更新



