2019-2020年九年级下期第二次月考化学专题训练(福建省莆田市荔城区中山中学)
| 1. 选择题 | 详细信息 |
|
下列物质中属于酸的是 A. H2CO3 B. NaHCO3 C. P2O5 D. Ba(OH)2 |
|
| 2. 选择题 | 详细信息 |
|
生活中处处有化学,下列说法不正确的是 A. 氢氧化钠具有碱性,可用于改良酸性土壤 B. 经常食用水果蔬菜可预防坏血病 C. 在潮湿的空气中铁易生锈 D. 治疗胃酸过多可用小苏打 |
|
| 3. 选择题 | 详细信息 |
|
将鸡蛋壳加入稀盐酸中有气泡生成,气体能使澄清石灰水变浑浊,则鸡蛋壳中含有下列离 子中的( ) A.氯离子 B.碳酸根离子 C.硫酸根离子 D.氢氧根离子 |
|
| 4. 选择题 | 详细信息 |
|
下列物质的溶液长期放置在空气中(不考虑水分蒸发),溶液质量因发生物理变化而减少的 是( ) A.烧碱 B.石灰水 C.浓盐酸 D.氯化钾 |
|
| 5. 选择题 | 详细信息 |
|
只用一种试剂就可鉴别NaCl、NH4Cl、Na2SO4三种溶液,该试剂是 A.KCl溶液 B.Ba(OH)2溶液 C.NaOH溶液 D.NaNO3溶液 |
|
| 6. 选择题 | 详细信息 |
|
稀盐酸和稀硫酸具有相似的化学性质,其本质原因是 A.都能与指示剂作用 B.都能电离出酸根离子 C.都能电离出氢离子 D.都含有氢元素 |
|
| 7. 选择题 | 详细信息 |
|
下列物质的水溶液pH依次减小的是() A.H2O,H2SO4,NaOH B.Ca(OH)2,H2O,HCl C.H2SO4,H2O,NaOH D.HCl,CaO,H2O |
|
| 8. 选择题 | 详细信息 |
|
下列图示的实验操作,正确的是( ) A.  稀释浓硫酸 B. 稀释浓硫酸 B.C.  测定溶液的 pH D. 测定溶液的 pH D. 干燥二氧化碳气体 干燥二氧化碳气体 |
|
| 9. 选择题 | 详细信息 |
|
下列各组物质分别放入足量的水中,能得到无色透明溶液的是( ) A. FeCl3、NaOH、NaCl B. Na2CO3、NaCl、Na2SO4 C. CuSO4、KCl、HCl D. Na2SO4、HCl、BaCl2 |
|
| 10. 填空题 | 详细信息 |
|
化学源于生活。请用化学知识回答下列问题。 (1)清蒸鱼富含营养素是________。 (2)聚乙烯能制成薄膜,因为它具有_______(填“热塑”或“热固”)性。废弃塑料不回 收会造成________污染。 (3)硫酸钾属于________(填“氮”或“钾”)肥。 (4)厨房中能用来除去水壶中水垢的物质是________(填“食醋”或“食盐水”)。 (5)为保障“舌尖上的安全”,下列做法合理的是________。(填字母) a 霉变大米蒸煮后食用 b 甲醛溶液浸泡虾仁防腐 c 适当使用食品添加剂 (6)家用液化气的主要成分之一是丙烷(C3H8),丙烷属于_______ (填字母)。 a 氧化物 b 化合物 c 无机物 d.有机物 |
|
| 11. 填空题 | 详细信息 | ||||||||||||||||
某同学把自制的紫薯汁(呈紫色),分别滴加到下列不同的试剂中,并记录观察到的 现象如下表所示
|
|||||||||||||||||
| 12. 填空题 | 详细信息 |
下图是氢氧化钙溶液和盐酸用滴加方式反应时,溶液 pH 随滴入溶液体积变化的曲 线。  (1)氢氧化钙和盐酸恰好完全反应时,溶液的 pH_____7(填“大于”或 “小于”或“等于”)。写出化学方程式_____。 (2)根据曲线判断,该反应是将_________(填“氢氧化钙溶液”或 “盐酸”,下同)滴入_____中。 (3)当滴入溶液的体积为 5mL 时,所得溶液中的溶质为 _____。 |
|
| 13. 推断题 | 详细信息 |
A-E 为铁、稀硫酸、硫酸铜溶液、澄清石灰水、碳酸钠溶液中的一种,其中 E 是 蓝色溶液,B 为固体。它们之间的关系如图所示(“—”表示相连的物质能发生反应,所涉及 反应均为初中常见的化学反应),请回答下列问题: 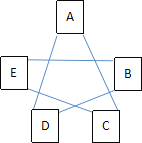 (1)D 的化学式为__________________。 (2)E 与 C 反应的化学方程式_________________。 (3)图中属于复分解反应的有______个。 (4)如果 A、C、D、E 都不变,各物质间的关系不变,B 还可能 是________________。 A Ag B KOH C BaCl2 D Mg(OH)2 E Fe2O3 |
|
| 14. 实验探究题 | 详细信息 |
某化学兴趣小组欲除去粗盐中的难溶性杂质和少量可溶性氯化镁、氯化钙等杂质,并配制氯化钠溶液。请参与实验并回答问题.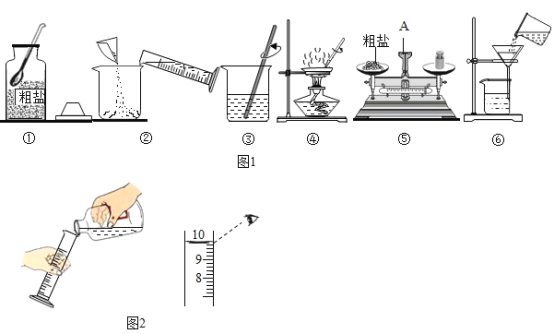 实验一:图 1 是同学们做粗盐提纯实验的操作示意图。请回答下列问题: (1)仪器 A 的名称是______________。 (2)图②中有处明显的读数错误,请指正______________。 (3)操作④中玻璃棒的作用是______________ 。 (4)粗盐提纯实验的操作顺序为______________(填操作序号)、称量精盐并计算产率。 实验二:除去粗盐中的可溶性杂质 (5)为将这些杂质除净,先将实验一得到的食盐溶于水,然后再进行如下操作即可得到较纯 的氯化钠:①加过量的 NaOH 溶液;②加过量的 Na2CO3 溶液;③过滤;④加过量的盐酸;⑤蒸发 ①请写出除去氯化钙反应的化学方程式______________。 ②其中,加过量的盐酸的目的是______________。 |
|
| 15. 实验探究题 | 详细信息 |
探究学习小组在实验室中用图1所示装置制取CO2并探究CO2与过氧化钠(Na2O2)的反应。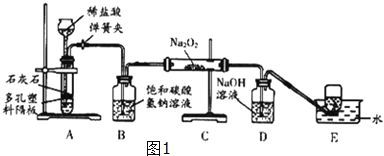 查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2,H2O发生反应: Na2O2+2CO2═2Na2CO3+O2,2Na2O2+H20═4NaOH+O2↑ 请回答下列问题: (1)装置A中发生反应的化学方程式为 ,利用装置A制取CO2的优点是 . (2)装置B的作用是吸收CO2中混有的HCl,发生反应的化学方程式为 . (3)装置D的作用是 . (4)装置E中收集到的气体是 (填化学式),该气体还可以用下列图2装置中的 进行收集(填写字母序号).  (5)为探究反应后装置C硬质玻璃管中固体的成分,该小组同学进行了如图3实验: 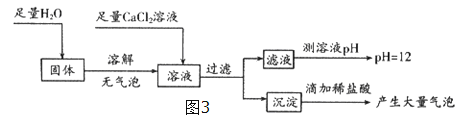 根据判断,反应后装置C硬质玻璃管中固体为 . |
|
| 16. 计算题 | 详细信息 |
|
为了测定某硝酸银溶液中溶质的质量分数,往10g硝酸银溶液中滴入足量的氯化钙溶液,充分反应后共生成0.574g沉淀。[发生反应的方程式:CaCl2+2AgNO3=2AgCl↓+Ca(NO3)2] 计算: (1)参加反应的硝酸银的质量。 (2)硝酸银溶液中溶质的质量分数。 |
|
最近更新



