2018届初三下册中考一模化学考题(江苏省盐城市)
| 1. | 详细信息 |
|
“绿水青山就是金山银山”,下列做法不符合这一理念的是 A. 建设高速铁路网,形成绿色环保的交通大动脉 B. 垃圾就地焚烧,减少运输成本 C. 推进新能源汽车的生产,实现经济和环境双赢 D. 植树造林,绿化城市 |
|
| 2. | 详细信息 |
|
以下实验中没有涉及到化学变化的是 A. 灼烧法区分羊毛纤维与棉纤维 B. 用小苏打和柠檬酸反应自制汽水 C. 石墨导电实验 D. 肥皂水区分硬水和软水 |
|
| 3. | 详细信息 |
|
下列图示实验操作中,正确的是 A.  长期存放 B. 长期存放 B.  废弃药品随意倒入水池 废弃药品随意倒入水池C.  从试管口部往下夹试管 D. 从试管口部往下夹试管 D.  加热烧杯中液体 加热烧杯中液体 |
|
| 4. | 详细信息 |
制造导弹的合金材料重要元素钕的某些信息如图所示,下列说法不正确的是 A. 属于金属元素 B. 核外电子数为 60 C. 原子质量为 144.2g D. 核内质子数为 60 |
|
| 5. | 详细信息 |
|
淀粉(C6H10O5)n 在空气中能直接燃烧,下列关于淀粉的说法错误的是 A. 氢元素的含量最高 B. 分子中C、H、O 三种原子个数比为 6:10:5 C. 属于有机物 D. 完全燃烧生成二氧化碳和水 |
|
| 6. | 详细信息 |
|
下列事实或现象的微观解释错误的是 ( ) A. 等质量的氧气和液态氧,氧气所占的体积大---气体分子间间隙比液体分子间间隙小 B. 二氧化碳和干冰都能使石灰水变浑浊---同种分子化学性质相同 C. 蔷薇花开,满园芬芳---分子在不停地运动 D. 酸具有相似化学性质---酸溶于水后都能解离出 H+ |
|
| 7. | 详细信息 | ||||||||||||
善于梳理化学知识,能使你头脑更聪明。以下对应不正确的一组是
|
|||||||||||||
| 8. | 详细信息 |
|
下列实验现象描述正确的是 A. 天然气在空气中燃烧发出淡蓝色火焰 B. 打开盛浓盐酸的瓶塞,瓶口处形成白烟 C. 把 NaOH 溶液滴入到 CuSO4 溶液中产生红褐色沉淀 D. 少量高锰酸钾放入足量汽油中并充分搅拌,能形成均一、稳定的紫色溶液 |
|
| 9. | 详细信息 |
根据如图的溶解度曲线判断,下列说法正确的是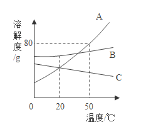 A. 50℃时,A 物质的溶解度为 80 B. 20℃时,B 的溶解度大于 A 的溶解度 C. 升温可使 C 物质的饱和溶液变成不饱和溶液 D. 将 50℃三种物质的饱和溶液分别降温到 20℃时,A 析出固体最多 |
|
| 10. | 详细信息 |
|
将锌粉加入到硫酸铜溶液中,一段时间后过滤,得蓝色滤液和滤渣。滤渣的成分是 A. Zn B. Cu C. Zn、Cu D. ZnSO4、Cu |
|
| 11. | 详细信息 |
|
下列各组物质在水溶液中能够大量共存,且加入无色酚酞试液后显红色的是 A. NaCl、Ca(NO3)2、HCl B. Ba(OH)2、Mg(NO3)2、Na2SO4 C. K2SO4、Na2CO3、NaNO3 D. AgNO3 、NaCl、KNO3 |
|
| 12. | 详细信息 | |||||||||||||||
如下表格中所选药品或方法不能达到实验目的的是
|
||||||||||||||||
| 13. | 详细信息 |
下图是以空气和其他原料合成 NH4NO3 的工业流程,下列说法不正确的是 ( ) A. ①中所得“其他气体”中稀有气体含量最高 B. 上述流程中涉及到的化合反应有 3 个 C. ④中参加反应的 O2 和 H2O 的质量之比 16:9 D. 理论上,若③和⑤中 NH3 的量相同,则合成 NH4NO3 时氨气的利用率最高 |
|
| 14. | 详细信息 |
|
下列图象不能正确反映其对应关系的是 ( ) A.  向稀盐酸中不断滴加氢氧化钠溶液 向稀盐酸中不断滴加氢氧化钠溶液B. 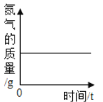 红磷在装有空气的集气瓶中燃烧 红磷在装有空气的集气瓶中燃烧C.  向二氧化锰中不断滴加过氧化氢溶液; 向二氧化锰中不断滴加过氧化氢溶液;D.  向饱和硝酸钾溶液中加入高锰酸钾固体。 向饱和硝酸钾溶液中加入高锰酸钾固体。 |
|
| 15. | 详细信息 |
|
烧杯盛有一定质量的碳酸钾和碳酸钙的固体混合物,向其中加入20g 的稀盐酸,恰好完全反应,将气体通入足量澄清石灰水中(气体全部被吸收),过滤,测得溶液质量减少2.8g。则所用稀盐酸的溶质质量分数是 ( ) A. 7.3% B. 18.25% C. 14.6% D. 23.2% |
|
| 16. | 详细信息 |
|
用化学用语表示: (1)水中氧元素的化合价 _____ (2)氯化铵中的阴离子_____, (3)两个甲烷分子_____ (4)成人缺少_____,严重时易患甲状腺肿大. |
|
| 17. | 详细信息 |
|
请从下列物质中选择适当的物质填空(填字母编号): A.聚乙烯 B.聚氯乙烯 C.硝酸钾 D.酒精 E.维生素 (1)用于食品包装 _____ (2)可作复合肥料_____ (3)既可作燃料又可用于消毒的_____ (4)蔬菜、水果中富含 _____。 |
|
| 18. | 详细信息 |
化学实验是科学探究的重要途径,请根据下列实验图示回答相关问题: (1)A 实验中分别将硫在空气和氧气中燃烧,硫在氧气里燃烧比在空气里燃烧更剧烈,说明了硫燃烧剧烈程度和 ________相关。 (2)B 实验中,硬质玻璃管中反应的化学方程式 ________;装置末端酒精灯的作用是________. (3)C 实验中,若要除去粗盐中难溶性的杂质,其正确操作步骤为 _________填序号), 步骤⑤中玻璃棒的作用是 ________;若按照②③①的步骤配制 50gl6%的氯化钠溶液,需要水的体积________(水的密度为 1g/mL)。若某同学所配溶液的溶质质量分数偏大,其原因可能是 ________ (填序号)。 A、称量时,砝码生锈,氯化钠质量偏大 B、氯化钠固体不纯 C、量取水时,俯视读数 D.装瓶时,有少量溶液洒出 |
|
| 19. | 详细信息 |
下图是实验室制取气体的部分装置,请回答下列问题: (1)仪器名称:① ________,② ________。 (2)用氯酸钾和二氧化锰制取并收集一瓶干燥氧气,可选用装置 ________(选填序号), 二氧化锰的作用是 ________,选用 B 装置制氧气的化学方程式为 ________。 (3)实验室制取 CO2 的化学方程式为 ________,若将发生装置由 B 改为 C, 其优点是________。 (4) SO2 是无色有刺激性气味的有毒气体,密度比空气大,其化学性质与 CO2 相似。用上图中 FGH 的组合收集一瓶干燥的 SO2,装置中导管按气流方向连接顺序是①→②→_______→_______→⑤(填序号);烧杯中 NaOH 溶液的作用是 ________(用化学方程式表示),漏斗的作用是________。 |
|
| 20. | 详细信息 |
|
碳酸钠在轻工、建材、纺织、国防、医药等工业中有重要的应用,我国化学家侯德榜创立了著名的“侯氏制碱法”,促进了世界技术的发展。 (查阅资料)①生产原料粗盐中含有少量可溶性杂质(MgCl2 和 CaC12)及不溶性杂质。 ②氨气极易溶于水,二氧化碳能溶于水。 ③生产原理:NaCl + NH3 + CO2+ H2O = NaHCO3↓+ NH4C1,分离得晶体 A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。 ④氯化铵分解的化学方程式是 NH4Cl===NH3↑+HCl↑。 ⑤部分生产流程如下图所示:  (问 题讨论) (1)溶液 A 中的溶质为 ________,流程中加入适量盐酸的作用是 ________。 (2)反应(2)中为提高产率,所通入气体的顺序是 ________(填字母序号). A.先通入 CO2 再通入 NH3 B.先通入 NH3 再通入 CO2 (3)上述生产流程中可循环使用的是 ________(填序号). A.CO2 B.NH3 C.HCl D.NaOH E.Na2CO3 (组成确定) (1)称取一定质量的纯碱样品,多次充分加热,称重,质量无变化; (2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀 HNO3,再滴加 AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ________(写化学式). (含量测定) 同学们为了测定该纯碱样品的纯度(假定只含一种上述杂质),设计了如下三组实验。甲组:取 12.0g 纯碱样品,向其中加入过量的盐酸,直至样品中无气泡冒出。将反应所得溶液小心蒸发,并将所得物质干燥、冷却至室温称得固体质量为 13.1g.样品中碳酸钠的质量分数为________。 乙组:取 12.0g 纯碱样品,利用下图所示装置,测出反应装置 C 增重了 4.1g(所加试剂均足量,每一步都反应完全).实验结束,发现乙组测定的质量分数偏小,其原因是_________。 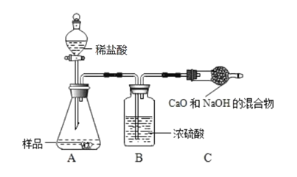 丙组:取 12.0g 的纯碱样品,完全溶于水,向其中加入过量的氯化钙溶液,待完全沉淀过滤、 洗涤、烘干称量固体质量,从而计算出碳酸钠的质量分数。组内同学提出意见,认为如果将氯化钙溶液换成氯化钡溶液则更好,老师认为有道理,原因是 ________。 |
|
最近更新



