山东省威海市2020-2021年高二上学期期末考试化学在线测验完整版
| 1. 选择题 | 详细信息 |
化学与生产、生活密切相关。下列说法错误的是( ) A.如图,对钢管的防护措施为牺牲阳极保护法 B.明矾和高铁酸钾(K2FeO4)都可净水,其原理相同 C.侯氏制碱法比索尔维制碱法食盐的利用率高 D.“保暖贴”在发热过程中应用的是原电池的工作原理 |
|
| 2. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.玻尔原子结构模型不但成功解释了氢原子光谱,而且还解释了其他原子光谱 B.基态氧原子轨道表示式 C.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 D.不同的能层所含的s能级的原子轨道数是不同的 |
|
| 3. 选择题 | 详细信息 |
|
设 A. B.惰性电极电解饱和食盐水,当阴极产生 C. D. |
|
| 4. 选择题 | 详细信息 |
|
现有6种物质:① A.既存在单键又存在双键的分子只有③ B.既存在非极性键又存在极性键的极性分子是③⑤ C.既存在 D.既存在离子键又存在极性共价键的是②④⑥ |
|
| 5. 选择题 | 详细信息 |
|
常温下,下列溶液中各组离子一定能够大量共存的是( ) A.  的溶液中: 的溶液中:B.使甲基橙变黄的溶液: C.澄清透明的溶液中: D. |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
下列分子或离子空间结构和中心原子的杂化方式有错误的是( )
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
过氧化氢在酸性环境中可氧化 ① ② ③ ④ 下列说法错误的是( ) A.该氧化过程总反应为: B. C. D.整个反应的速率由反应④决定,选择合适的催化剂可以加快反应速率 |
|
| 8. 选择题 | 详细信息 |
a~e为短周期元素,其原子序数与其某种化合价的关系如图所示。下列说法正确的是( )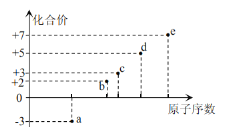 A.气态氢化物的还原性:a>d B.c与e形成的化合物为离子化合物 C.第一电离能:b>c D.d和e都不存在同素异形体 |
|
| 9. 选择题 | 详细信息 |
用电解原理可提高由丙烯腈( A.a为阳极,电极反应为 B.溶液中 C.电解池总反应为  D.通电一段时间后,左右两室溶液的 |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
下列实验方案不能达到目的的是( )
|
||||||||||||||||
| 11. 选择题 | 详细信息 |
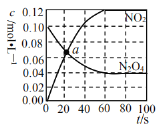 A.混合气体的密度始终保持不变 B.a点v(正)>v(逆) C.前 D.该温度下反应的平衡常数Kp与k1、k2间的关系为Kp·k2=k1 |
|
| 12. 选择题 | 详细信息 |
科学家利用实验与计算机模拟合成氨催化反应,其反应历程如图所示。其中吸附在催化剂表面的物种用*标注。下列说法错误的是( ) A.历程中最大能垒的反应为: B.氨气的脱附是放热反应 C.从速率和平衡角度综合考虑,压强越大、温度越低越有利于工业合成氨 D.NH3的及时脱附有利于空出催化剂上的活性位点 |
|
| 13. 选择题 | 详细信息 |
|
某种用于电池添加剂的结构为 A.分子不具有旋光性 B.1个分子中含8个σ键 C.O的杂化类型为sp2、sp3 D.组成分子的三种元素都位于周期表中p区 |
|
| 14. 选择题 | 详细信息 |
W、X、Y、Z为原子序数依次增大的短周期主族元素,可形成如图所示的化合物,其中W和Y同主族,W、X、Y三者的原子序数之和为20,Z核外最外层电子数是Y+核外电子数的一半。下列说法正确的是( ) A.X、Y两种元素的简单离子半径大小顺序为X>Y B.X、Y形成的化合物中每种原子的最外层都满足8电子稳定结构 C.W分别与X、Y形成的二元化合物均为共价化合物 D.Y和Z二者最高价氧化物对应的水化物按一定比例反应可生成该化合物 |
|
| 15. 选择题 | 详细信息 |
常温下,用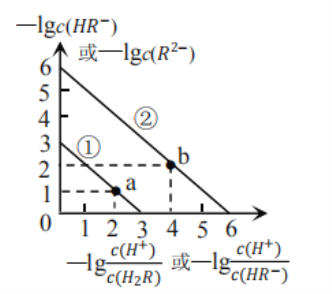 A. B.滴定过程中,当pH=6时, C.若 D. |
|
| 16. | 详细信息 | ||||||||||||
X、Y、Z、W、R、Q为元素周期表中前四周期的六种元素。
回答下列问题: |
|||||||||||||
| 17. | 详细信息 |
碘是合成甲状腺激素的必需成分,海带中含有丰富的碘。常用 已知: (1)灼烧时应将海带置于___________中(填仪器名称)。 (2)加入适量 (3)盛装  (4)经实验测定平均消耗 |
|
| 18. | 详细信息 |
|
镍、铜等金属及其化合物在工农业生产上有重要用途。回答下列问题: (1)基态Ni的核外电子排布式为___________,Ni位于元素周期表中___________区(填“s”“p”“d”或“ds”),其核外电子占据的最高能层符号为___________。 (2)第二电离能I2(Ni)___________I2(Cu)(填“<”或“>”),其原因是___________。 (3)Ni与CO能形成如图所示的配合物Ni(CO)4,该分子中  A.水 B.四氯化碳 C.苯 D.稀H2SO4 (4)将Cu粉加入浓氨水中,并通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式为___________。 (5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________个,其中提供孤对电子的原子为___________(写元素符号)。  |
|
| 19. | 详细信息 |
|
硫和碳是重要的非金属元素,其单质及化合物在工业生产中有重要应用。回答下列问题: (1)已知: ① ② ③ 则反应 (2)利用 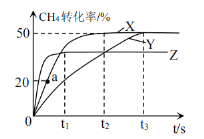 ①下列现象说明反应已经达到平衡状态的是___________(填字母序号) A.2v(CH4)=v(CO) B. C.容器内气体密度保持不变 D.混合气体的平均相对分子质量不变 ②曲线X对应实验条件下,从起始至达到平衡时,用 ③由曲线Y到曲线X采取的措施可能是___________;由曲线X到曲线Z采取的措施可能是___________。 ④反应速率v=v(正)-v(逆)=k(正) |
|
| 20. | 详细信息 |
|
氧族元素及其化合物在生产、生活中发挥着重要的作用。回答下列问题: (1)工业上常用硫化物(FeS等)作沉淀剂除去废水中的Cu2+等重金属离子。已知常温下  (2)工业上常用连二亚硫酸钠 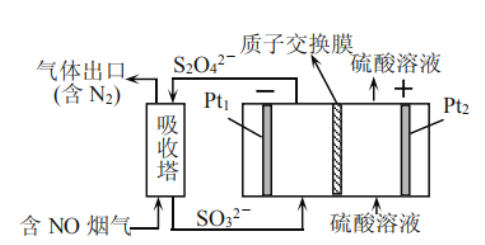 (3)硒是人体必需的微量元素。工业上将含硒工业废料处理得到亚硒酸(  ①将 ②25℃时, ③已知硒酸的电离方程式为: A. B. C. D. |
|
最近更新





