西藏自治区拉萨那曲第二高级中学2020届高三第五次月考理综化学试卷
| 1. 选择题 | 详细信息 |
|
化学与生产、生活等多方面都密切相关,下列说法中不正确的是( ) A.石油分馏可直接获得乙烯、丙烯和丁二烯等产品 B.晶体硅制得的光电池,能将光能直接转化为电能 C.误食重金属离子时可先喝大量牛奶或豆浆后再及时就医 D.缺铁性贫血可以服用亚铁盐的药剂来进行治疗 |
|
| 2. 选择题 | 详细信息 |
|
NA为阿伏伽德罗常数的值。下列说法正确的是( ) A.1 mol羟基(-OH)中含7NA个电子 B.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA D.6.2g白磷(分子式为P4)中所含P—P键的数目为0.2NA |
|
| 3. 选择题 | 详细信息 |
有机化合物萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是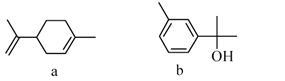 A.a和b均属于苯的同系物 B.a和b分子中所有碳原子均处于同一平面上 C.a和b均能使酸性KMnO4溶液褪色 D.a物质与足量氢气加成所得产物的一氯代物最多有6种 |
|
| 4. 选择题 | 详细信息 |
|
下列材料或物质的应用与其对应的性质完全相符合的是 A.Mg、Al合金用来制造飞机外壳——合金熔点低 B.葡萄酒中含SO2——SO2有漂白性 C.SiO2用来制造光导纤维——SiO2耐酸性 D.食品盒中常放一小袋Fe粉——Fe粉具有还原性 |
|
| 5. 选择题 | 详细信息 |
四种短周期元素在周期表中的相对位置如下所示,其中T所处的周期序数与族序数相等,下列判断错误的是  A.W和R形成的化合物属于共价化合物 B.元素R与氢形成的化合物有很多种 C.含T的盐溶液可能能与NaOH溶液反应也可能与盐酸反应 D.常温下,T的单质与W的最高价氧化物对应水化物的浓溶液反应产生气体 |
|
| 6. 选择题 | 详细信息 | ||||||||||||||||||||
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
|
|||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
对可逆反应2A(s)+3B(g) ①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高 A.①② B.④ C.③ D.④⑤ |
|
| 8. 综合题 | 详细信息 |
|
金属锰在冶金工业中用来制造特种钢,常作为脱硫剂和去氧剂,其化合物广泛应用于电池、机械制造业等领域。 (1)以软锰矿(主要为MnO2)为原料通过热还原法得到金属锰涉及的两个反应: ①3MnO2(s)=Mn3O4(s)+ O2(g) △H1= akJ•mol-1 ②3Mn3O4(s)+ 8Al(s) =4Al2O3(s) + 9Mn(s) △H2= bkJ•mol-1 已知Al的燃烧热为 △H3=ckJ•mol-1,则MnO2与Al发生铝热反应的热化学方程式为___________。 (2)科研人员将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液 体积不变),发生反应Mn(s)+ Sn2+(aq) 请回答下列问题: ①为加快反应速率可以采取的措施有__________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________________。 ②下列能说明反应已达平衡的有____________________(填编号)。 A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+) C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变 ③室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=________________,Mn2+的产率为____________。  ④若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则 再次平衡时c(Mn2+) =____________(不考虑离子水解的影响)。 (3)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为_____________________,阳极附近溶液的pH____________(选填“增大”、“减小”或“不变”)。 |
|
| 9. 实验题 | 详细信息 |
某兴趣小组为了探究铁粉与水蒸气反应的产物,做了下面实验。 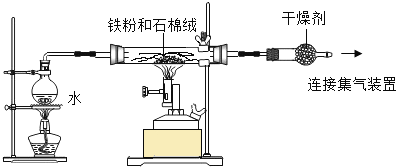 资料:在不同温度下,铁粉与水蒸气反应的产物不同。 Fe +H2O 实验一:某兴趣小组用下图所示装置,使铁粉与过量水蒸气充分反应并检验固体产物的组成。 (1)实验过程中,应先点燃___________(选填“酒精灯”或“酒精喷灯”);目的是__________________,装置中石棉绒的作用是_____________________。 (2)若在实验中的某段时间内生成H2 0.2g,则这段时间内参加反应的铁粉质量至少是___________g。 实验二:铁粉完全反应后,兴趣小组对硬质玻璃管中生成的FeO和Fe3O4的质量进行测定,实验流程如下图。  (1)实验前检查装置A的气密性:关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差__________,则气密性良好。 (2)装置A中发生的反应方程式_______________________________________。 (3)为了安全,在点燃酒精灯之前,在F装置出口b处必须______________________。 (4)装置C中所放试剂为_________,装置B的作用是_________________________。 (5)干燥管E右边又连接干燥管F的目的是_________________________________。 若无干燥管F,测得Fe3O4的质量将_______________(填“偏大”、“偏小”或“无影响”)。 |
|
| 10. | 详细信息 |
用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4•2H2O)的工业流程如图。已知:①草酸钴晶体难溶于水,②RH为有机物(难电离) (1)滤渣I的主要成分是_____________(填化学式) ,写出两种能提高酸浸速率的措施_____________ 、 ___________。 (2) 操作①用到的主要仪器有___________________。 (3) H2O2是种绿色氧化剂,写出加入H2O2后发生反应的离子方程式________________________________________。 (4)加入氧化钴的目的是______________________________。 (5)加入(NH4)2C2O4反应得到草酸钴晶体的离子方程式________________________________,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验是否洗涤干净的方法是__________________________________________。 (6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-) ,测定溶液中C2O42-的浓度, KMnO4标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___________(填“偏高”、“偏低“或“无影响”)。 |
|
| 11. 填空题 | 详细信息 |
|
碳、铜、锡及其化合物有许多用途。回答下列问题 (1)在元素周期表里,锡和碳同族,锡在第五周期。基态锡原子的价电子排布式为__________,据此推测,锡的常见正价是__________。 (2)磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金。磷化铜与水反应产生有毒的磷化氢(PH3)气体,PH3分子的空间构型为__________;P、S的第一电离能(I1)的大小为I1(P) __________I1(S)(填“>”“<”或“=”) (3)CO32-中C原子的杂化轨道类型为__________;乙烯分子中σ键与π键数目之比为__________。 (4)NH3的沸点__________(填“高于”或“低于”)PH3的沸点,原因是____________________。 (5)磷青铜晶体的晶胞结构如图所示,该晶体中P原子位于由铜原子形成的__________的空隙中。若晶体密度为ag·cm-3,P与最近的Cu原子的核间距为__________nm(用含NA的代数式表示)。  |
|
| 12. 推断题 | 详细信息 |
化合物G( )是一种医药中间体,它的一种合成路线如下: )是一种医药中间体,它的一种合成路线如下:  已知:RCOOH 回答下列问题: (1)C→D的化学方程式为________________________________________。 (2)H是一种高聚酯,其结构简式为____________________;A→B、D→H的反应类型分别是________________、______________。 (3)下列关于化合物D的说法正确的是__________(填标号)。 A.一定条件下,D还可以发生催化氧化反应 B.1molD分别与足量的Na和 NaHCO3溶液反应,产生的气体体积比为1:1(在相同状况下) C.一定条件下,D发生消去反应生成的有机物不存在顺反异构体 D.一定条件下,D不能与HBr发生取代反应 (4)符合下列条件F的同分异构体有__________种,其中核磁共振氢谱有四组吸收峰的结构简式为____________________。 ①遇FeCl3溶液显紫色;②能发生水解反应;③苯环上有两个取代基。 (5)已知酚羟基不易与羧酸发生酯化反应,设计由苯酚、甲苯为起始原料制备苯甲酸苯酚酯( |
|
最近更新



