黄梅国际育才高级中学2019年高二化学下期期中考试在线免费考试
| 1. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 丙烷分子的比例模型:  B. CH3CH2CH2CH2CH3和 C. 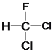 和 和 为同一物质(不考虑立体异构) 为同一物质(不考虑立体异构)D. CH3CH2OH和 |
|
| 2. 选择题 | 详细信息 |
|
有机物的种类繁多,但其命名是有规则的。下列有机物命名正确的是( ) A. CH2=CH—CH=CH2 1,3-二丁烯 B. C.  甲基苯酚 甲基苯酚 |
|
| 3. 选择题 | 详细信息 |
|
由CH2=CH2→CH3CH2Cl→CH3CH2OH→CH3CHO→CH3COOH的转化过程中,经过的反应为( ) A. 加成→消去→氧化→取代 B. 消去→取代→氧化→加成 C. 加成→取代→消去→氧化 D. 加成→取代→氧化→氧化 |
|
| 4. 选择题 | 详细信息 |
|
设阿伏伽德罗常数的值为NA,则下列说法正确的是 A.标准状况下,11.2LCCl4所含的分子数为0.5NA B.7.8g苯分子中碳碳双键的数目为0.3NA C.常温常压下,4.2gC2H4和C9H18混合物中含有的碳原子数为0.3NA D.常温下,1molC3H8含有C﹣H共价键数为10NA |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||
白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是
|
|||||||||||||||||||||
| 6. 选择题 | 详细信息 |
已知某有机物A的核磁共振氢谱如上图所示,下列说法中,错误的是( ) A. 若 A的分子式为C3H6O2,则其结构简式为CH3COOCH3 B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 D. 若A的化学式为C3H6O2,则其同分异构体至少有三种 |
|
| 7. 选择题 | 详细信息 |
下列装置(部分夹持装置及石棉网已省略)或操作能达到实验目的的是 A. 用装置①制乙烯 B. 用装置②分离苯和苯酚 C. 用装置③制备乙酸乙酯 D. 用装置④验证硫酸、碳酸、苯酚酸性强弱 |
|
| 8. 选择题 | 详细信息 |
|
某一溴代烷水解后的产物在红热铜丝催化下,最多可被空气氧化生成4种不同的醛,该一溴代烷的分子式可能是 A. C4H9Br B. C5H11Br C. C6H13Br D. C7H15Br |
|
| 9. 选择题 | 详细信息 |
|
常温下水的离子积常数KW=1.0×10−14,在100 ℃时水的离子积常数K'W=1.0×10−12。若将下列溶液加热至90 ℃(忽略溶液体积变化),则溶液pH不变的是 A. 硫酸钠溶液 B. 稀硫酸 C. 氢氧化钠溶液 D. 浓盐酸 |
|
| 10. 选择题 | 详细信息 |
|
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
|
| 11. 选择题 | 详细信息 |
图甲是CO2电催化还原为碳氢化合物(CxHy)的工作原理示意图,用某钾盐水溶液做电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,用硫酸为电解质溶液。下列说法中不正确的是( ) A. 甲中铜片作阴极,K+向铜片电极移动 B. 乙中正极发生的电极反应为CO2-6e-+6H+=CH3OH+H2O C. 乙中H2SO4的作用是增强溶液的导电性 D. 甲中若CxHy为C2H4,则生成1mol C2H4的同时生成3mol O2 |
|
| 12. 选择题 | 详细信息 |
|
室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元 酸HA,溶液pH的变化曲线如图所示。下列说法正确的是  A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B. a、b两点所示溶液中水的电离程度相同 C. pH=7时,c(Na+)=c(A-)+c(HA) D. b点所示溶液中c(A-)>c(HA) |
|
| 13. 选择题 | 详细信息 |
某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4 还原为 Na2S。下列说法不正确的是  A. 充电时,太阳能转化为电能,电能又转化为化学能 B. M 是阴离子交换膜 C. 放电时,a 极为负极 D. 充电时,阳极的电极反应式为 3I--2e-=I3- |
|
| 14. 选择题 | 详细信息 |
合成氨反应为:N2(g)+3H2(g)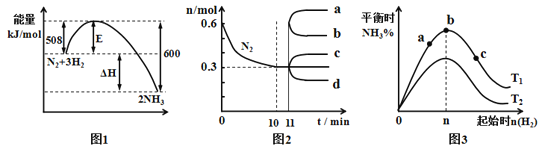 A.由图1可知2NH3(g) B.图2中0~10min内该反应的平均速率v(H2)=0.09mol·L-1·min-1 C.图2中从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d D.图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
|
| 15. 选择题 | 详细信息 |
|
苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分) A. 提高CO2充气压力,饮料中c(A-)不变 B. 当pH为5.0时,饮料中 C. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 D. 结合H+的能力:A->HCO3- |
|
| 16. 计算题 | 详细信息 |
|
为测定某有机化合物A的结构,进行如下实验: Ⅰ.分子式的确定: (1)将有机物A置于氧气流中充分燃烧,实验测得生成7.2gH2O和13.2gCO2,消耗氧气10.08L(标准状况),则该物质中各元素的原子个数之比是____________________。  (2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为________,该物质的分子式是_______________。 (3)根据价键理论,预测A可能的结构简式: _________________________。 Ⅱ.结构式的确定: (4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱如图②,则A的结构简式为___________________________。 |
|
| 17. 实验题 | 详细信息 |
青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药,已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法,乙醚浸取法的主要工艺为(如图): 请回答下列问题: (1)对青蒿进行干燥破碎的目的是 _______________________________。 (2)操作I需要的玻璃仪器主要有:烧杯、玻璃________ ,操作Ⅱ的名称是__________。 (3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:  ①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用) ②青蒿素样品的质量为28.2g,用合理改进后的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_________________。 ③要确定该有机物的分子式,还必须知道的数据是__________________________。 (4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与 ________(填字母)具有相同的性质 A.乙醇 B.乙酸 C.葡萄糖 D.乙酸乙酯 |
|
| 18. 计算题 | 详细信息 |
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在, CrO42-和Cr2O72-在溶液中可相互转化2CrO42-+2H+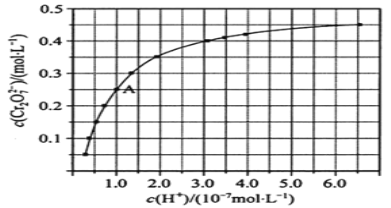 (1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__________(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__________。 (2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH_______0(填“大于”“小于”或“等于”)。 (3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。 |
|
| 19. 综合题 | 详细信息 | ||||||||||||||||||
|
CO2是一种重要的化工原料,依据题给信息,回答下列问题: Ⅰ.碳酸钠可利用CO2采用氨碱法生产 (1)碳酸钠可作为碱使用的原因是_____________(用离子方程式表示)。 (2)已知:①2NaOH(s)+CO2(g)=Na2CO3(s)+H2O(g) ΔH1=−127.4 kJ/mol ②NaOH(s)+CO2(g)=NaHCO3(s) ΔH2=−131.5kJ/mol 反应2NaHCO3(s)=Na2CO3(s)+ H2O(g) +CO2(g)的ΔH=___________ kJ/mol。 Ⅱ.在体积为2 L的密闭容器中,充入1mol/LCO2 和1mol/L H2,进行如下化学反应: CO2(g)+H2(g)
|
|||||||||||||||||||
| 20. 推断题 | 详细信息 |
《茉莉花》是一首脍炙人口的中国民歌。茉莉花香气的成分有多种,乙酸苯甲酯 ( )是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下: )是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下: 回答下列问题: (1)B的结构简式为____________,A中官能团名称为____________; (2)写出反应②、⑥的化学方程式_________________,__________________; (3)上述反应中属于取代反应的有________(填写序号); (4) 乙酸苯甲酯 (  )满足下列条件的同分异构体有________种。 )满足下列条件的同分异构体有________种。A.属于芳香族化合物 B.苯环上只有一个支链 C.能发生水解反应 |
|
最近更新



