佛山市在线答题
| 1. 选择题 | 详细信息 |
|
下列叙述正确的是 A.1 mol H2O的质量为18 g/mol B.CH4的摩尔质量为16 g C.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4 L |
|
| 2. 选择题 | 详细信息 |
|
下列各组物质依次为酸、混合物和碱的是 A.硝酸钠、CuSO4·5H2O、KOH B.硫酸、空气、纯碱 C.NaHSO4、NH3·H2O、熟石灰 D.硝酸、食盐水、烧碱 |
|
| 3. 选择题 | 详细信息 |
|
下列物质的水溶液中,加入Ba(OH)2溶液后原溶液中溶质的阴、阳离子都减少的是 A.Na2CO3 B.CuSO4 C.FeCl3 D.Ca(NO3)2 |
|
| 4. 选择题 | 详细信息 |
|
下列各组物质相互混合后,不会发生离子反应的是 A.K2SO4溶液和Mg(NO3)2溶液 B.FeSO4溶液和锌块 C.NaOH溶液和Fe2(SO4)3溶液 D.醋酸钠(CH3COONa)溶液和盐酸 |
|
| 5. 选择题 | 详细信息 |
|
能够用离子方程式:Ca2++CO A.石灰乳和碳酸钠溶液反应 B.澄清石灰水和足量NaHCO3溶液反应 C.氯化钙溶液和碳酸钾溶液反应 D.澄清石灰水和少量CO2反应 |
|
| 6. 选择题 | 详细信息 |
|
下列溶液中氯离子浓度最大的是 A.100 mL 0.8 mol·L-1 MgCl2溶液 B.50 mL 0.5 mol·L-1 AlCl3溶液 C.200 mL 1 mol·L-1 NaCl溶液 D.200 mL 2 mol·L-1 KClO3溶液 |
|
| 7. 选择题 | 详细信息 |
|
下列关于氯及其化合物的叙述正确的是 A.氯气的性质很活泼,它与氢气混合后立即发生爆炸 B.实验室制取氯气时,多余的氯气可以用氢氧化钙溶液吸收 C.久置的氯水没有漂白性 D.检验氯化氢气体中是否混有Cl2的方法是将气体通入硝酸银溶液 |
|
| 8. 选择题 | 详细信息 |
|
下列变化需要加入氧化剂才能实现的转化是 A.浓H2SO4→SO2 B.KClO3→O2 C.H2S→SO2 D. |
|
| 9. 选择题 | 详细信息 |
单质到盐的转化关系可表示为: 下述转化关系不正确的是( ) A.Na B.Mg C.C D.S |
|
| 10. 选择题 | 详细信息 |
|
对下列溶液中离子检验正确的是( ) A. 某无色溶液滴入稀盐酸,产生气泡,证明该溶液一定含有CO32-离子 B. 向某种溶液中加入稀盐酸酸化的硝酸银,有白色沉淀,证明含Cl-离子 C. 某溶液中先滴加氯化钡溶液,有白色沉淀,证明含SO42-离子 D. 某无色溶液中滴入无色酚酞试液显红色,证明该溶液一定显碱性 |
|
| 11. 选择题 | 详细信息 |
|
下列关于胶体的说法,正确的是 A.纳米材料粒子直径一般在 1~100 nm之间,因此纳米材料属于胶体 B.用可见光束照射可以区别溶液和胶体 C.将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 D.胶体与溶液都可以通过滤纸、半透膜和分子筛 |
|
| 12. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数,下列叙述中正确的是 A.1 mol NH B.25℃、1.01×105Pa时,22gCO2中含有1.5NA个原子 C.78g Na2O2固体中O2-的数目为2NA D.将98g H2SO4溶解于500mL水中,所得溶液中H+的物质的量浓度为4 mol/L |
|
| 13. 选择题 | 详细信息 |
|
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是 A. 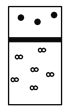 B. B.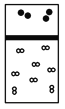 C. C. D. D. |
|
| 14. 选择题 | 详细信息 |
|
下列叙述中正确的是( ) A.等质量的O2、O3中所含氧原子个数之比为2:3 B.标准状况下,体积相等的CCl4和Cl2,前者含有的氯原子数是后者的两倍 C.1molCO和CH4的混合气体所含的碳原子数和1molCO2所含的碳原子数相等 D.10g NH3中含有原子数目约为4×6.02×1023 |
|
| 15. 选择题 | 详细信息 |
|
现有①1mol纯净的Na2CO3 ②1molNa2CO3和NaHCO3的混合物,下列描述正确的是 A.分别与足量盐酸反应时①消耗盐酸量少 B.分别与足量氯化钡溶液反应时②产生的沉淀多 C.分别配成等体积的溶液时②的c(Na+)大 D.相同条件下,分别与足量盐酸反应时放出的CO2体积相等 |
|
| 16. 选择题 | 详细信息 |
|
已知还原性由强到弱的顺序为SO32-> I->Br-,向NaBr、NaI、Na2SO3的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是( ) A. NaCl B. NaCl、Na2SO4、NaI C. NaCl、Na2SO4、I2 D. NaCl、NaBr、Na2SO4 |
|
| 17. 选择题 | 详细信息 |
|
下列说法正确的是 A. B. C. D. |
|
| 18. 选择题 | 详细信息 |
某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( ) A.该实验说明Cl2分子具有漂白性 B.该实验说明H+扩散速度比HClO分子快 C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色 D.若用久置的氯水进行实验,现象相同 |
|
| 19. 选择题 | 详细信息 |
|
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e → SO42- + 4H+;(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e → 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为 A.NaClO B.NaClO4 C.HClO D.ClO2 |
|
| 20. 选择题 | 详细信息 |
|
将固体X投入过量的Y中,能生成蓝色沉淀并放出一种无色可燃气体,则X和Y分别可能是 A.Na和AlCl3溶液 B.Zn和H2SO4溶液 C.Na2O2和CuSO4溶液 D.Na和CuSO4溶液 |
|
| 21. 选择题 | 详细信息 |
|
某溶液中含有HCO A.NO |
|
| 22. 选择题 | 详细信息 | |||||||||||||||
下列实验操作正确的是
|
||||||||||||||||
| 23. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A.将 CO2通入 CaCl2溶液:CO2+H2O+Ca2+=CaCO3↓+2H+ B.氧化镁与稀硫酸反应:O2-+2H+ =H2O C.碳酸钡与醋酸反应:BaCO3 +2H+ = Ba2+ +H2O + CO2↑ D.硫酸铜溶液和氨水: Cu2+ + 2NH3•H2O = Cu(OH)2↓ + 2NH |
|
| 24. 选择题 | 详细信息 |
|
我国古代有“银针验毒”的记载。“银针验毒”的反应原理之一是:4Ag +2H2S +O2 == 2X +2H2O,下列有关该反应的说法正确的是 A.Ag得到电子 B.X为AgS C.O2被还原 D.每生成1molX转移电子数4NA |
|
| 25. 选择题 | 详细信息 |
|
镍氢充电电池有着广泛应用,镍及其化合物能发生下列反应: ①Ni+2HCl=NiCl2+H2↑ ②NiO+2HCl=NiCl2+H2O ③NiO2+4HCl=NiCl2+Cl2↑+2H2O Ni(OH)2不溶于水。对上述反应的分析判断错误的是 A.镍能与氯化铜溶液发生置换反应 B.反应②和③都是复分解反应 C.NiCl2能与NaOH溶液发生复分解反应 D.反应①、③中Ni的化合价都发生了变化 |
|
| 26. 选择题 | 详细信息 |
|
工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法正确的是 A. 0.2 mol/L 的BaCl2溶液中含有的Cl-数目为0.4NA B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积为 0.224 L C. 常温常压下,17 g H2O2中所含分子总数为 0.5NA D. 此反应中,每消耗1 mol H2O2,转移的电子数为1 NA |
|
| 27. 选择题 | 详细信息 |
|
溶液中只存在五种离子,各离子个数比为:Cl-∶ A. |
|
| 28. 实验题 | 详细信息 |
如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。 (1)装置C中盛装的溶液是___________,D中试剂的作用是___________。 (2)E中的红色布条是否褪色?___________(填“是”或“否”),写出F中反应的化学反应方程式:___________。 (3)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为___________。 |
|
| 29. 填空题 | 详细信息 |
|
回答下列问题 (1)已知CuO具有氧化性,能够和氨气反应,产物中含有两种单质,请写出在加热条件下CuO和NH3反应的化学方程式_______________________________________。 (2)在一定条件下,RO (3)Mn2+、Bi3+、BiO (4)在3BrF3+5H2O=9HF+Br2+HBrO3+O2中,若有15个H2O分子参加反应,则被水还原的溴原子的个数为_____________。 |
|
| 30. 实验题 | 详细信息 |
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。 (1)图Ⅰ、Ⅱ所示实验能够达到实验目的的是(填装置序号)_______; (2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为__________________________,______________________; (3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______; (4)另有两瓶溶液,已知分别是等物质的量浓度的K2CO3和NaHCO3,请你写出两种不同的鉴别方法。(写出简要操作、现象和结论) ①___________________。 ②___________________。 |
|
| 31. | 详细信息 | ||||||
我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图: |
|||||||
最近更新



