九年级后半期期中化学免费试卷完整版(2018-2019年福建省龙岩市永定区湖坑中学)
| 1. 选择题 | 详细信息 |
|
2018年3月,生态文明被历史性地写入宪法,下列做法属于保护生态环境的是( ) A. 随意焚烧秸秆 B. 发展清洁能源 C. 乱丢废旧电池 D. 提倡毁林造田 |
|
| 2. 选择题 | 详细信息 |
|
中华美食食材来源广泛,以下食材里蛋白质含量最高的是( ) A. 海带 B. 竹笋 C. 豆腐 D. 萝卜 |
|
| 3. 选择题 | 详细信息 |
|
如图中实验操作正确的是( ) A. 读液体体积  B. 检验氢气纯度 B. 检验氢气纯度 C. 闻气体气味  D. 熄灭酒精灯 D. 熄灭酒精灯 |
|
| 4. 选择题 | 详细信息 |
如图为锌的原子结构示意图,下列说法正确的是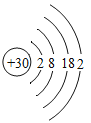 A. 锌的相对原子质量为30 B. 锌在化学反应中易失去电子 C. 锌离子的质子数小于30 D. 锌与稀盐酸反应生成ZnCl |
|
| 5. 选择题 | 详细信息 |
|
下列化学用语的使用及其表示的意义,正确的是( ) A. Cl2—2个氯原子 B. FeSO4—硫酸铁 C. 2CO2—2个二氧化碳分子 D. Mg+2—镁元素的化合价为 |
|
| 6. 选择题 | 详细信息 |
|
草甘膦( C3H8NO5P)是全球使用最广泛的除草剂之一,具有酸性。下列说法正确的是( ) A. 草甘膦由18个原子构成 B. 氢、氧元素的质量比为8:5 C. 草甘膦溶液可长期贮存在铁质容器中 D. 该物质中氧元素的质量分数最大 |
|
| 7. 选择题 | 详细信息 |
太阳能吸附式空气取水器可用于野外获取淡水,工作原理如图所示。下列说法错误的是( )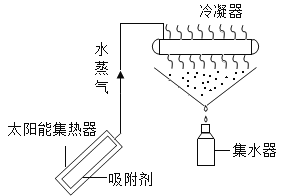 A. 该过程发生了物理变化 B. 冷凝过程中分子间距发生变化 C. 该装置将太阳能转化为化学能 D. 该法可缓解淡水资源匮乏问题 |
|
| 8. 选择题 | 详细信息 | |||||||||||||||
下列各组物质的鉴别方法正确的是( )
|
||||||||||||||||
| 9. 选择题 | 详细信息 |
|
氰氨基化钙(CaCN2)是一种重要的化工原料,制备CaCN2的化学方程式为CaCO3+2X=CaCN2+CO↑+H2↑+CO2↑.该反应中下列说法正确的是( ) A. 可用氢氧化钠溶液处理有害的气体产物 B. 反应后气体质量减少 C. X的化学式为HCNO D. X溶液的 |
|
| 10. 选择题 | 详细信息 |
如图1所示,连接好装置和压强传感器。气密性良好的烧瓶内充满CO2.分别用注射器向烧瓶中迅速注入等量的水、饱和石灰水和40%的氢氧化钠溶液,关闭活塞,一段时间后再振荡烧瓶。观察传感器所示气压变化如图2所示。下列说法错误的是( )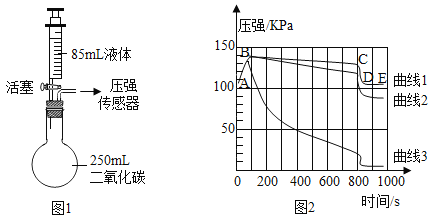 A. 曲线2代表加入的是水 B. 吸收 C. AB段气压增大的原因之一是液体的添加使气体体积缩小 D. 曲线1中CD段气压“急速”减少的原因是振荡烧瓶使瓶内气体迅速反应 |
|
| 11. 填空题 | 详细信息 |
|
2019央视春晚长春分会场演员们所穿发热服的材料是石墨烯。石墨烯可通过使石墨的厚度逐渐变薄获得。 (1)石墨烯属于______(填“单质”或“化合物”)。 (2)石墨烯可用于海水淡化,通过机械手段进一步压缩石墨烯薄膜中的毛细通道尺寸,控制孔径大小,能高效过滤海水中的盐分,该过程属于______(填“物理变化”或化学变化”)。 (3)石墨烯卷曲处理可以得到碳纳米管,可推测碳纳米管具有的物理性质为______。 (4)石墨烯的化学性质与石墨相似,石墨烯不完全燃烧的化学方程式是______。 (5)由同种元素组成的不同单质称为同素异形体,请列举一种石墨烯的同素异形体______。 |
|
| 12. 填空题 | 详细信息 |
2018年10月,中科院大连化物所与福州大学化学学院合作发展了一种固态Z一机制复合光催化剂,实现了太阳能人工光合成燃料过程,反应的微观示意图如图所示: (1)该转化过程中,______(填“原子”或“分子”)没有发生变化,化合价升高的元素是______。 (2)写出该过程的化学方程式______。 (3)两种反应物的质量比为______。 (4)该过程可缓解______,是人类解决环境问题的途径之一。 |
|
| 13. 综合题 | 详细信息 |
硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。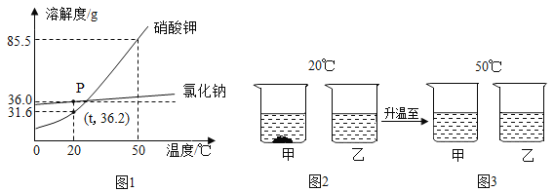 (1)图1中P点含义是________ (2)图2中烧杯甲中溶液的溶质是________(填化学式)。 (3)下列说法正确的是________(填标号)。 A图2烧杯甲中的溶液是饱和溶液 B图2烧杯乙中的溶液为饱和溶液 C.图3烧杯甲中溶液质量比烧杯乙中溶液质量大 (4)图3烧杯乙溶液中溶质的质量分数是________(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行_____(填“是”或“否”)。 |
|
| 14. 流程题 | 详细信息 |
为实现废物“资源化”利用的目的,以电石渣[主要成份为Ca(OH)2和CaCO3.其中Ca(OH)2为微溶物]为原料制备KClO3,其主要流程如图所示: (1)氯化过程中,Cl2与Ca(OH)2作用,发生了一系列变化,最终生成Ca(ClO3)2和CaCl2,该反应的化学方程式中这两种生成物的化学计量数比为1:5 ①生成Ca(CIO3)2的化学方程式______。 ②提高Cl2转化为Ca(ClO2)2的转化率的可行措施有______(填标号)。 A 适当减缓通入Cl2速率 B 充分搅拌浆料 C 加水使Ca(OH)2完全溶解 (2)活性炭的作用是______;步骤甲的操作名称为______;残渣A中一定含有______。 (3)向步骤I得到的溶液中加入稍过量KCl固体可将Ca(ClO2)2转化为KClO3,该反应的基本反应类型为______。 |
|
| 15. 实验探究题 | 详细信息 |
|
如图1是实验室中常见装置,回答下列问题。 查阅资料:常温下,氯气是一种密度比空气大,能溶于水,难溶于饱和食盐水的有毒气体,可利用MnO2固体与浓盐酸加热制取。  (1)写出仪器a的名称为______。 (2)实验室制取CO2的化学方程式是______。 (3)制取气体时,装置丙中长颈漏斗下端管口必须伸入液面以下的理由______。 (4)实验室制取Cl2应选用的发生装置是___(填标号),该装置导出的气体中所含的杂质气体有___。 (5)常温下,如图2所示收集Cl2的方法中可行的是______(填标号)。 |
|
| 16. 科学探究题 | 详细信息 |
|
纯碱(Na2CO3)是一种重要的有机化工原料。侯氏制碱法制出的纯碱常含少量NaCl杂质,化学兴趣小组对工业纯碱样品进行实验探究。 Ⅰ研究Na2CO3的性质 (1)Na2CO3溶液显____(填“酸性”、“中性”或“碱性”)。 (2)检验样品中碳酸根的方法是____。 Ⅱ设计以下实验方案,测定样品中Na2CO3的质量分数。 [方案一]取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算。 (3)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为____。 (4)实验中判断沉淀是否完全的方法是____。 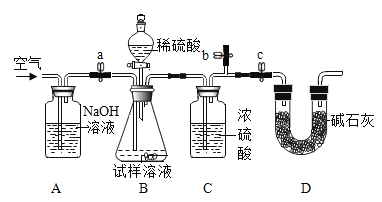 [方案二]采用如图装置,检查装置气密性;称取样品m1g于锥形瓶中,称装置D质量为m2 g;关闭止水夹c,打开止水夹a、b,缓慢鼓入空气数分钟,关闭止水夹a、b,打开止水夹c,缓慢加入稀硫酸至不再产生气体为止;打开止水夹a,缓慢鼓入空气数分钟,再称量装置D质量为m3g。 (查阅资料)浓硫酸具有吸水性,碱石灰的成分为CaO和NaOH固体 (5)装置B中发生的化学方程式为______。 (6)样品中Na2CO3的质量分数的计算式是______。 (7)反应后鼓入空气的目的是______。 (8)该测定结果比实际值偏高,从装置上分析其原因可能是______;改进措施为______。 |
|
| 17. 推断题 | 详细信息 |
物质A、B、C的转化关系(“→”为一步进行反应)如图所示。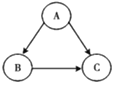 (1)若A、B、C均是金属单质,则金属活泼性最强的是______(填标号)。 (2)若A、B、C为含碳量依次递减的化合物;B、C分别含有钠、镁、钙、钡四种元素中的一种,物质A为______;“B→C”反应的化学方程式为______。 (3)若A、B、C分别为NaCl、NaNO3、Na2SO4三种溶液中的一种,则C是______溶液;“A→C”反应的化学方程式为______(写一个)。 |
|
| 18. 计算题 | 详细信息 |
|
氢能源是21世纪最具有发展潜力的清洁能源。中科院大连化物所首次实现了一种高能量效率制备高纯氢气的策略,该反应原理为:CO+H2O |
|
最近更新



