2018-2019年高二上期期末考试化学试卷(新疆维吾尔自治区昌吉市第九中学)
| 1. 选择题 | 详细信息 |
|
化学与生产、生活密切相关。下列事实与化学反应速率无关的( ) A. 食品、蔬菜贮存在冰箱和冰柜里,能延长保鲜时间 B. 家用铁锅、铁铲等餐具保持干燥,能减缓生锈 C. 制造蜂窝煤时加入生石灰,减少SO2排放 D. 煤气换成天然气时,要调整灶具进气(或出气)管 |
|
| 2. 选择题 | 详细信息 |
|
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol C(s)+O2(g)=2CO(g) △H=-220 kJ/mol H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为 A. -332 B. -118 C. +350 D. +130 |
|
| 3. 选择题 | 详细信息 |
|
已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2 2CO(g)+O2(g)=2CO2(g) △H3 4Fe(s)+3O3(g)=2Fe2O3(s) △H4 3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5 下列关于上述反应焓变的判断正确的是 A. △H1>0,△H3<0 B. △H2>0,△H4>0 C. △H1=△H2+△H3 D. △H3=△H4+△H5 |
|
| 4. 选择题 | 详细信息 |
|
已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1 2H2O2(l)===2H2O(l)+O2(g) ΔH2 2H2(g)+O2(g)===2H2O(l) ΔH3 则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是 A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3 C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3 |
|
| 5. 选择题 | 详细信息 |
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如图所示,图中的ΔH表示生成1 mol产物的数据。可知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是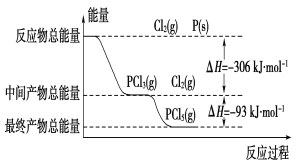 A. 其他条件不变,升高温度有利于PCl5的生成 B. 反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1 C. P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g)ΔH=-306 kJ·mol-1 D. 其它条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小 |
|
| 6. 选择题 | 详细信息 |
如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( ) A. 由MgCl2制取Mg是放热过程 B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2 C. 常温下氧化性:F2<Cl2<Br2<I2 D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol |
|
| 7. 选择题 | 详细信息 |
下列生产生活中需要增大化学反应速率的是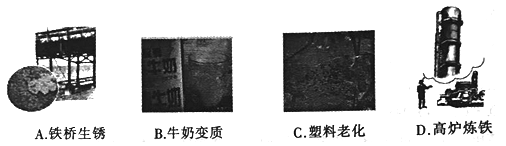 A. A B. B C. C D. D |
|
| 8. 选择题 | 详细信息 |
|
可逆反应达到化学平衡状态的重要特征是 ( ) A. 反应停止了 B. 正、逆反应的速率都为0 C. 正、逆反应都还在进行 D. 正、逆反应的速率相等且不为0 |
|
| 9. 选择题 | 详细信息 |
|
反应:A(气)+3B(气) A. 正反应速率加大,逆反应速率变小 B. 正反应速率变小,逆反应速率加大 C. 正反应速率和逆反应速率都变小 D. 正反应速率和逆反应速率都变小 |
|
| 10. 选择题 | 详细信息 |
|
在反应2A(g) + B(g) A. 2ν(A)=ν(B) B. 3ν(B)=ν(C) C. 4ν(C)=3ν(D) D. 2ν(A)=ν(D) |
|
| 11. 选择题 | 详细信息 |
|
下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是 A. 2NO2 C. N2+3H2 |
|
| 12. 选择题 | 详细信息 |
|
下列热化学方程式中,△H能正确表示物质的燃烧热的是 A. CO(g) +1/2O2(g) ==CO2(g); △H=-283.0 kJ/mol B. C(s) +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol C. H2(g) +1/2O2(g)==H2O(g); △H=-241.8 kJ/mol D. 2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol |
|
| 13. 选择题 | 详细信息 |
已知某可逆反应m A(g)+n B(g) 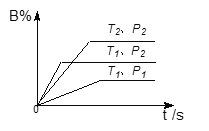 A. T1<T2,P1>P2,m+n>p,△H<0 B. T1>T2,P1<P2,m+n>p,△H>0 C. T1<T2,P1>P2,m+n<p,△H<0 D. T1>T2,P1<P2,m+n<p,△H>0 |
|
| 14. 选择题 | 详细信息 |
|
在下列各溶液中,离子一定能大量共存的是 ( ) A. 强碱性溶液中:CO32-、Na+、AlO2-、NO3- B. 由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3- C. 强碱性的溶液中:K+、Al3+、Cl-、SO42- D. 酸性溶液中:Fe2+、Al3+、NO3-、I- |
|
| 15. 选择题 | 详细信息 |
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是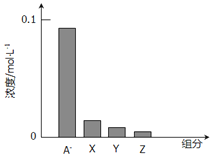 A. HA是强酸 B. 该混合液pH=7 C. 图中x表示HA,Y表示OH-,Z表示H+ D. 该混合溶液中:c(A-)+c(Y)=c(Na+) |
|
| 16. 选择题 | 详细信息 |
|
25℃时,在浓度都为1 mol·L-1的(NH4)2SO4、NH4H CO3、NH4HSO4、NH4Cl的四种溶液中,测得c(NH4+)分别为a、b、c、d(单位为mol·L-1)。下列判断正确的是 A. a=2b=2c=2d B. a>b>c> d C. a>c>d>b D. a>c>b>d |
|
| 17. 综合题 | 详细信息 | ||||||||||||||||||
根据下表所示化学反应与数据关系:
|
|||||||||||||||||||
| 18. 综合题 | 详细信息 | |||||||||||||||||||||||||
实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)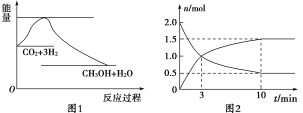 (1)为探究反应原理,现进行如下实验,在体积为2 L的密闭容器中,充入2 mol CO2和8 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) =________; ②该反应的平衡常数表达式K=________。 (2)830 ℃,反应的平衡常数K=1,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(填“A”“B”“C”或“D”)。
|
||||||||||||||||||||||||||
| 19. 综合题 | 详细信息 | ||||||||||||||||||||||
|
Ⅰ一定条件下,体积为1 L的密闭容器中发生如下反应: SiF4(g)+2H2O(g) (1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。 a.v消耗(SiF4)=4v生成(HF) b.容器内气体压强不再变化 c.容器内气体的总质量不再变化 d.HF的体积分数不再变化 (2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
|
|||||||||||||||||||||||
| 20. 综合题 | 详细信息 |
根据如图填空: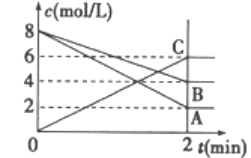 (1)反应物是______________,生成物是______________。 (2)在2 min内用A、B、C表示的化学反应速率分别为____________、____________、____________。 (3)该反应的化学方程式是____________________________。 |
|
| 21. 填空题 | 详细信息 |
|
反应3Fe(s)+4H2O(g) (1)增加Fe的量,其正反应速率的变化是__________(填“增大”“不变”或“减小”,以下相同)。 (2)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。 (3)保持体积不变,充入N2 使体系压强增大,其正反应速率__________,逆反应速率__________。 (4)保持压强不变,充入N2使容器的体积增大,其正反应速率__________,逆反应速率__________。 |
|
| 22. 综合题 | 详细信息 |
可逆反应:aA(g)+bB(g)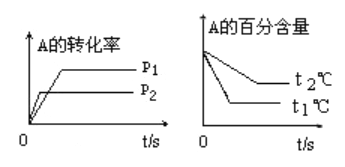 (1)压强p1比p2_____________(填“大”或“小”);(a+b)比(c+d)_____________(填“大”或“小”);温度t1比t2℃ _________(填“高”或“低”);正反应为______________热反应. (2)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式____________________________。 (3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2固体和H2O(l)。已知室温下2 g SiH4自燃放出热量89.2 kJ,该反应的热化学方程式为_________________________。 (4)已知反应:N2(g)+O2(g)=2NO(g) △H1 2H2(g)+O2(g)=2H2O(g) △H2 N2(g)+3H2(g)=2NH3(g) △H3 利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H4的反应焓变为_____________(用含△H1、△H2、△H3的式子表示)。 |
|
| 23. 填空题 | 详细信息 |
|
在含有弱电解质的溶液中,往往有多个化学平衡共存。 (1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1 NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是__________。 A.c(HA)<c(A-) B.c(HA)一定大于0.1 mol·L-1 C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)] (2)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。 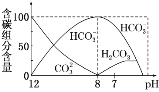 回答下列问题: ①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。 ②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是___________。 ③已知在25 ℃时,CO32-水解反应的平衡常数Kh=2×10-4,当溶液中c(HCO3-)∶c(CO32-)=2∶1时,溶液的pH=____________。 |
|
| 24. 综合题 | 详细信息 |
|
研究电化学原理与应用有非常重要的意义。 (1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。 ①锌锰电池负极上的电极反应式为:______________________________。 ②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。 (2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ①充电时阴极反应为:________________________________________。 ②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的PH为______(假设溶液体积不变,产物无损耗)。 (3)如图是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。Pt2上的电极反应式为:_______________________________________ 。 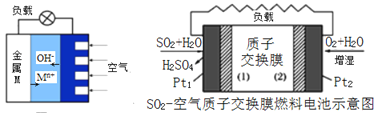 (4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH− 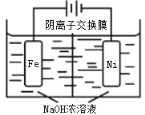 |
|
- 2018-2019年高一上册期中考试化学考试(河北省正定县第三中学)
- 2019版必修第一册(专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教)
- 云南省曲靖市陆良县2020届高三前半期第二次适应性考试化学
- 2019-2020年高一上半年第二次阶段考试化学考题(青海省西宁市海湖中学)
- 2018-2019年高二上册半期考试化学在线测验完整版(四川省遂宁二中)
- 2019-2020年高二下学期期末考试化学题同步训练免费试卷(河北省秦皇岛市卢龙县木井中学)
- 2018-2019年高二上册期末考试化学在线测验完整版(湖南省永州市祁阳县)
- 云南师范大学附属中学2021届高三高考适应性月考卷理科综合化学网上检测无纸试卷带答案和解析




