滁州市高一化学上册期末考试考题同步训练
| 1. 选择题 | 详细信息 |
|
分类方法在化学学科的发展中起到了非常重要的作用,下列5种分类标准中合理的有 ①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 ②根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应 ③根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 ④根据氧化物中是否含有金属元素,将氧化物分为酸性氧化物和碱性氧化物 ⑤根据物质在水溶液里或熔融状态下能否导电,将化合物分为电解质和非电解质 A. 5种 B. 4种 C. 3种 D. 2种 |
|
| 2. 选择题 | 详细信息 |
|
下列实验操作正确的是 ( ) A. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 B. 在进行蒸馏操作中,加热一段时间后发现忘加碎瓷片,应采取的正确操作是立即补加 C. 实验时常把氢氧化钠固体放在托盘天平左盘的滤纸片上进行称量 D. 对盛有氢氧化铁胶体的U形管通一会儿直流电后,连接电源正极的电极附近颜色逐渐加深 |
|
| 3. 选择题 | 详细信息 | |||||||||||||||
下列实验对应的现象及结论均正确的是( )
|
||||||||||||||||
| 4. 选择题 | 详细信息 |
|
NO用高铁酸钠(Na2FeO4)对河、湖水消毒是城市饮用水处理的新技术,已知反应Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是 A. Na2O2既是氧化剂又是还原剂 B. Fe2O3在反应中显氧化性 C. 3 mol Na2O2发生反应,有12 mol电子转移 D. Na2FeO4能消毒杀菌是因其具有强氧化性 |
|
| 5. 选择题 | 详细信息 |
|
在Na2SO4、K2SO4、KCl的混和溶液中,如果c(Cl-)= 0.1mol/L,c(Na+)= 0.2mol/L,c(SO42-)= 0.3mol/L,c(K+)= xmol/L,则x的值是 A. 0.5 mol/L B. 0.4 mol/L C. 0.3 mol/L D. 0.2 mol/L |
|
| 6. 选择题 | 详细信息 |
|
我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积又成丹砂”。这句话所涉及的反应有:①HgS+O2 =Hg+SO2 ②Hg+S=HgS。下列有关说法正确的是 A. 反应①、②中有一个是氧化还原反应 B. 反应①中Hg、O两种元素被还原 C. 反应①中每生成l mol SO2共转移4mole- D. 反应②中Hg 为氧化剂、S 是还原剂 |
|
| 7. 选择题 | 详细信息 |
下列实验操作正确且能达到相应实验目的的是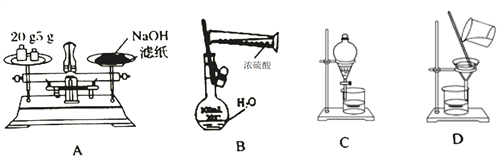 A. 称量NaOH 固体 B. 配制100mL0.1mol/L 的H2SO4 溶液 C. 家里的食用胡麻油不小心混入了大量的水采取的分离方法 D. 提纯Fe(OH)3 胶体 |
|
| 8. 选择题 | 详细信息 |
|
下列应用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( ) A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞 B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫 C.厨房中常用碳酸钠溶液洗涤餐具上的油污 D.可用碳酸钠与醋酸制取少量二氧化碳 |
|
| 9. 选择题 | 详细信息 |
|
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( ) A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强 B. 常温时溶解度:Na2CO3>NaHCO3,且溶于水时均放热 C. 在酒精灯加热的条件下,前者不分解,后者分解 D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,都产生白色沉淀 |
|
| 10. 选择题 | 详细信息 |
|
将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( ) A. n1=n2=n3 B. n2>n1>n3 C. n1>n2>n3 D. n1>n3>n2 |
|
| 11. 选择题 | 详细信息 |
|
下列说法正确的是() ①实验室制取Cl2时,为了防止环境污染,多余的氯气可以用澄淸石灰水吸收; ②Cl2的化学性质活泼,它与H2混合后立即发生爆炸; ③检验HCl气体中是否混有Cl2的方法是将气体通入AgNO3溶液; ④新制氯水的氧化性强于久置氯水; ⑤除去CO2气体中的HC1,可将气体通入饱和碳酸氢钠溶液中。 A. ③⑤ B. ④⑤ C. ①②③ D. ②③④ |
|
| 12. 选择题 | 详细信息 |
A、B、C三种不含结晶水的固体物质的溶解度曲线如图,下列说法中不正确的是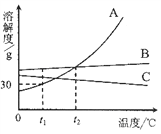 A. t1℃时,A的饱和溶液65 g中含有溶剂50 g B. 将t1℃ A、B、C三种物质的饱和溶液升温至t2℃ 时,溶液中溶质的质量分数是A=B>C C. A中含少量C时可用降温结晶法提纯A D. 25%的A溶液降温至t1℃时会有晶体析出 |
|
| 13. 选择题 | 详细信息 |
右图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是( ) A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉 C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉 |
|
| 14. 选择题 | 详细信息 |
|
下列有关离子(或物质)的检验及结论,不正确的是 ( ) A. 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 B. 在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32- C. 向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42- D. 氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性 |
|
| 15. 选择题 | 详细信息 |
|
某溶液中可能含有H+、NH4+、Mg2+、Al3+、CO32-、SO42-中的几种。 ①若加入锌粒,最终产生无色无味的气体; ②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示,则下列说法正确的是( ) 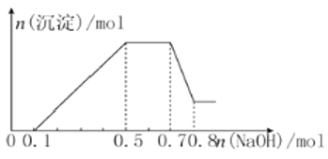 A. 溶液中的阳离子只有H+、Mg2+、Al3+ B. 溶液中n(NH4+)=0.2 mol C. 溶液中一定不含CO32-,可能含有SO42- D. n(H+)∶n(Al3+)∶n(Mg2+)=1∶1∶1 |
|
| 16. 选择题 | 详细信息 |
|
下列说法正确的是 A. 2 mol·L−1KCl溶液与1 mol·L−1 K2SO4溶液等体积混合后,c(K+)为2 mol·L−1 B. 120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20 g C. 50 mL 1 mol·L−1 NaCl溶液与100 mL 0.5 mol·L−1 NaCl溶液中所含的Cl−物质的量浓度相同 D. 把5 g胆矾(CuSO4·5H2O)溶于45 g水中,所得溶液溶质的质量分数为10% |
|
| 17. 选择题 | 详细信息 |
|
除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( ) A. KNO3溶液(NaCl):加热蒸发得浓溶液后,降温,析出晶体后过滤 B. NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸 C. NaCl溶液(Br2):加CCl4,萃取分液 D. KNO3溶液(AgNO3):加过量KCl溶液,过滤 |
|
| 18. 选择题 | 详细信息 |
|
实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ A. 该王水中硝酸的物质的量浓度是3.5mol/L B. 该王水中氧元素的质量是100.8g C. 该王水的密度约为1.24g/ D. 该王水中HCl的质量分数约为26.2% |
|
| 19. 选择题 | 详细信息 |
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是 ( )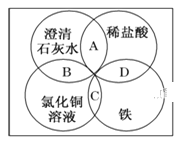 A. OH—+HCl=H2O+C1— B. Ca(OH)2+Cu2+=Ca2++Cu(OH)2 C. Fe+CuCl2=Cu+FeCl2 D. Fe+2H+=Fe2++H2↑ |
|
| 20. 实验题 | 详细信息 |
|
用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应用电子分析天平准确称取一定质量的K2Cr2O7(已知M(K2Cr2O7)=294.0 g·mol-1。) (1)计算配制250 mL 0.01000 mol/L K2Cr2O7溶液时需要用电子分析天平准确称量K2Cr2O7的质量是________g(保留4位有效数字)。 (2)配制溶液时,一般可以分为以下几个步骤: ①称量 ②计算 ③溶解 ④颠倒摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 完成该溶液配制,将其正确的操作顺序补充完整为___________⑧⑤___________。 本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒,还有 _________________。 (3)使用容量瓶前必须进行的一步操作是_____________。 (4)配制0.01000 mol/L K2Cr2O7溶液时,下列操作会引起所配溶液浓度偏高的是_______。 ①没有洗涤烧杯和玻璃棒且未将洗涤液注入容量瓶 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线 ⑤定容时俯视刻度线 ⑥称量一定质量的K2Cr2O7中含有KCl 杂质 ⑦向容量瓶中转移液体时,玻璃棒的末端位于容量瓶刻度线以上 (5)配制0.01000 mol/L K2Cr2O7溶液,定容时不慎加水超过了刻度线,应如何处理:_____________。 |
|
| 21. 实验题 | 详细信息 |
实验室用浓盐酸和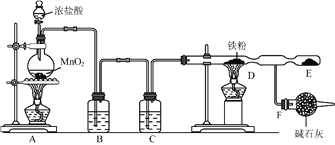 ⑴装置 ⑵装置 ⑶实验时,先点燃 ⑷ ⑸用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式: ___________________________________________________________________。 |
|
| 22. 实验题 | 详细信息 |
过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2 == 2Na2CO3 + O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠为原料,制取O2,设计出如下实验装置: (1)A中制取CO2 的装置,应从下列图①、② 中选哪个图:________。  A装置中发生反应的离子方程式为 ______________________________。 (2)B装置的作用是________________,C装置内可能出现的现象是__________ 。为了检验E中收集到的气体,在取出集气瓶后,__________________________(简要表述操作过程及结论)。 (3)若E中的石灰水出现轻微白色浑浊,请说明原因:_______________ (用离子方程式及简要文字描述)。 |
|
最近更新



