2018-2019年高一上册期末考试化学题开卷有益(河南省平顶山市)
| 1. 选择题 | 详细信息 |
|
下列有关金属及其合金的说法中,错误的时候 A.硬铝、青铜、不锈钢都属于合金,合金的性能一般优于纯金属 B.日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 C.为节能环保,提倡使用单车,单车零件所含 金属元素中只含铁元素 D.纳米铜的水溶液具有丁达尔效应 |
|
| 2. 选择题 | 详细信息 |
|
下列有关化学试剂在实验室中的保存方法 正确的是 A.少量钠用石蜡封存 B.用塑料瓶保存氢氟酸 C.用无色透明试剂瓶保存氯水 D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液 |
|
| 3. 选择题 | 详细信息 |
|
下列关于胶体和溶液的说法错误的是 A.溶液呈电中性,胶体带有电荷 B.溶液中分散质微粒能透过滤纸,胶体中分散质微粒也能透过滤纸 C.制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水中 D.胶体区别于其他分散系的本质特征是分散质的微粒 直径在1~100nm |
|
| 4. 选择题 | 详细信息 |
|
下列叙述正确的是 A.根据金属镁能导电可判断:镁为电解质 B.根据分类的观点可判断:纯碱属于碱类 C.根据是否有电子转移可判断:Na与Cl2反应属于氧化还原反应 D.根据都能使有色物质褪色这一现象推断:氯水和活性炭的漂白原理相同 |
|
| 5. 选择题 | 详细信息 |
|
粗盐水过滤后仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤可以除去这些杂质。①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液; ③加入稍过量的BaCl2溶液;④过滤; ⑤滴入稀盐酸至无气泡产生 A.③①②④⑤ B.③②①④⑤ C.②③①④⑤ D.③④②①⑤ |
|
| 6. 选择题 | 详细信息 |
|
设NA表示阿伏伽德罗常数的值。下列说法正确的是 A.NA的单位是摩尔 B.16g16O中含有的氧原子数为NA C.标准状况下,22.4L的任何气体所含原子数为NA个 D.相同体积的O2(g)和NO2(g)分子数均为NA |
|
| 7. 选择题 | 详细信息 |
|
下列有关实验操作错误的是 A.过滤操作中,漏斗的尖端应该紧靠烧杯内壁 B.蒸馏完毕后,应该先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 C.向容量瓶转移液体时,引流用的玻璃棒不可以接触容量瓶内壁 D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线 |
|
| 8. 选择题 | 详细信息 |
体检时的一些指标常用物质的量浓度表示(可将元素近似折算成相应离子)。根据下图相关数据,下列分析不正确的是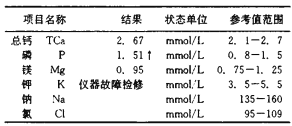 A. 1mmol/L=1.0×10-3mol/L B. 可用焰色反应测定钾离子的含量 C. 该报告中Mg2+指标正常 D. 若某人10mL血清样本中含钙离子1.2毫克,则其钙含量略偏高 |
|
| 9. 选择题 | 详细信息 |
|
下列反应的离子方程式正确的是 A.NaHCO3溶液与盐酸反应:CO32-+2H+=H2O+CO2↑ B.FeCl3溶液加入铜粉:Fe3++Cu= Fe2++Cu2+ C.用醋酸溶液除水垢:2H++CaCO3=Ca2++H2O+CO2↑ D.Cl2与NaOH溶液反应:Cl2+2OH-= Cl-+ ClO-+ H2O |
|
| 10. 选择题 | 详细信息 |
|
将3.2gCu与过量的8mol/L 40mL HNO3反应,硝酸的还原产物为NO2和NO,(体积变化忽略不计)反应结束后测得溶液中c(H+)为4 mol/L,则溶液中所含c(NO3-)为 A.4 mol/L B.5.6 mol/L C.6.5 mol/L D.6.3 mol/L |
|
| 11. 选择题 | 详细信息 |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是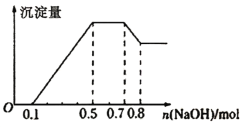 A.溶液中的阳离子只有H+、Mg2+、Al3+ B.溶液中一定不含CO32-和SO42-,可能含有Cl- C.溶液中n(Mg2+)=0.1mol D.n(H+) :n(NH4+) : n(Al3+) : n(Mg2+)=2:4:2:1 |
|
| 12. 选择题 | 详细信息 |
|
下列实验装置不可能达到实验目的的是 A. 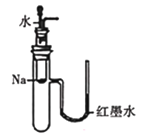 验证Na与水反应是否为放热反应 验证Na与水反应是否为放热反应B. 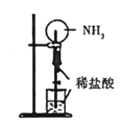 用NH3做喷泉实验 用NH3做喷泉实验C.  观察纯碱的焰色反应 观察纯碱的焰色反应D. 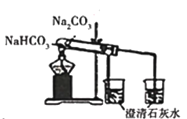 比较Na2CO3、NaHCO3的稳定性 比较Na2CO3、NaHCO3的稳定性 |
|
| 13. 选择题 | 详细信息 |
|
常温下,下列各组离子因发生氧化还原反应不能大量共存的是 A.pH=1的溶液中:Fe3+、K+、I-、Cl- B.在含大量Fe3+溶液中:NH4+、Na+、Cl-、SCN- C.能与金属铝反应生成氢气的溶液中:NH4+、Al3+、SO42-、Cl- D.在强碱溶液中:Na+、K+、Cl-、HCO3- |
|
| 14. 选择题 | 详细信息 |
|
有A、B、C、D四种物质,已知它们能发生下列变化:A2++B=B2++A; A2++C=C2++A; B2++C=C2++B; C2++D=D2++C,由此可推知,各物质的氧化性、还原性强弱顺序错误的是 ①氧化性:A2+>B2+>C2+>D2+ ②氧化性:D2+>C2+>B2+>A2+ ③还原性:A>B>C>D ④还原性:D>C>B>A A.①③ B.②③ C.②④ D.①④ |
|
| 15. 选择题 | 详细信息 |
|
下列有关叙述正确的是 A.相同条件下,体积相等的CO气体和CO2气体它们所含的氧原子数目之比为1:1 B.同体积、同密度的N2O和CO2,两种气体的分子数一定相等 C.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为2NA D.1L0. 45 mol/L NaCl溶液中Cl-的物质的量浓度比0.1L0. 15 mol/L AlCl3溶液大 |
|
| 16. 选择题 | 详细信息 |
|
下列有关溶质的质量分数和物质的量浓度的计算结果错误的是 A.密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5% B.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7 mol/L ,则此溶液中K+的物质的量浓度为0.2 mol/L C.将5 mol/L 的Mg(NO3)2溶液amL 稀释至bmL,稀释后溶液中NO3-的物质的量浓度为 D.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度ρg/cm3,则此溶液的物质的量浓度为 |
|
| 17. 综合题 | 详细信息 | ||||
某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
|
|||||
| 18. 推断题 | 详细信息 |
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答: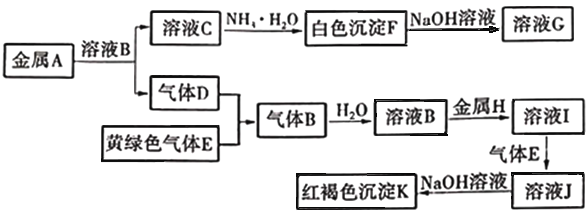 (1)写出下列物质的化学式:B是_________________, F是_________________,K是_________________。 (2)写出反应 “A→C”的离子方程式:_________________________________________。 (3)写出反应 “I→J”的化学方程式:_________________________________________。 (4)在溶液中滴加NaOH溶液,可观察到的现象是_____________________________。 |
|
| 19. 综合题 | 详细信息 |
|
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。实验室制取氯气除了用浓盐酸和二氧化锰外还可以利用下列反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需要加热。请你根据所学知识回答下列问题 (1)该反应中氧化产物与还原产物的物质的量之比为_____________________。 (2)把氯气通入紫色石蕊溶液中,可以观察到的现象是________________________________。 (3)实验室配制好2.0mol/L NaOH溶液,需要这种溶液____________mL才能与4.48L氯气(标准状况)恰号完全反应。 (4)已知Br2的水溶液因浓度不同而呈现橙色或红棕色,NaBr溶液中缓缓通入Cl2时,可以看到无色溶液逐渐变为红棕色,请写出对应的离子方程式_________________________________。 (5)现需490mL 2.0mol/L NaOH溶液: ⅰ所需称量的氢氧化钠固体的质量是__________________。 ⅱ上述实验需要的仪器有天平(含砝码)、药匙、烧杯、量筒、玻璃棒、胶头滴管、______________。 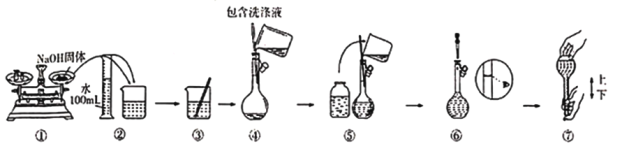 ⅲ某同学部分配制过程如图所示,你认为有错误的操作是_____________________;若按操作所示称量时,指针向左偏,则所配溶液浓度将____________________(填“偏高”“偏低”或“不变”) |
|
| 20. | 详细信息 |
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程如下图所示 (1)从流程图可知,Zn、Fe中能与NaOH溶液反应的是_______________________。 (2)向不溶物中加入稀硫酸发生反应的离子方程式是____________________________________。 (3)加入适量H2O2的目的是__________________________________。 (4)如何证明已生成了Fe3O4胶体?_____________________________________________________。 (5)流程中所需的硫酸溶液由焦硫酸(H2SO4·SO3)溶于水配制而成,其中的SO3都转化为硫酸,若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为__________________mol/L。 (6)稀硫酸也可以用浓硫酸和水配制。已知4 mol/L的硫酸溶液密度为ρ1g/cm3,2 mol/L的硫酸溶液密度为ρ2g/cm3。100g物质的量浓度为4 mol/L的硫酸溶液与___________mL水混合,使硫酸的物质的量浓度减小到2 mol/L(用含ρ1、ρ2的式子表示) |
|
最近更新



