银川市在线答题
| 1. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是 A.将lmolCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA(N表示粒子数) B.用惰性电极电解CuSO4溶液一段时间后,若加入29.4gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为1.2NA C.H2(g)+I2(g) D.100g质量分数17%的H2O2溶液中极性键数目为NA |
|
| 2. 选择题 | 详细信息 | ||||||||||||||||||||
下列实验的现象与结论相对应的是
|
|||||||||||||||||||||
| 3. 选择题 | 详细信息 |
某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S,下列说法不正确的是 A.充电时,太阳能转化为电能,电能又转化为化学能 B.放电时,a极为正极 C.充电时,阳极的电极反应式为3I--2e-= D.M是阳离子交换膜 |
|
| 4. 选择题 | 详细信息 |
如图是某另类元素周期表的一部分,下列说法正确的是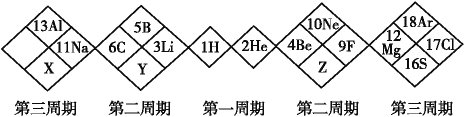 A.简单阴离子的半径大小:X>Z>Y B.单质的氧化性:X>Y>Z C.简单氢化物沸点:Y>X>Z D.X的最高价氧化物对应的水化物为三元酸 |
|
| 5. 选择题 | 详细信息 |
|
某固体混合物中可能含有Na+、K+、 A.一定是K2SO3和NaCl B.可能是Na2SO4和KCl C.可能是NaCl和K2CO3 D.一定是Na2CO3和NaCl |
|
| 6. 选择题 | 详细信息 |
下列图示与对应的叙述相符的是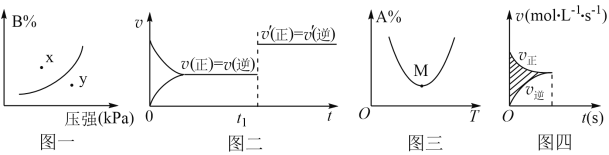 A.图一表示反应:mA(s)+nB(g) B.图二是可逆反应:A(g)+B(s) C.图三表示对于化学反应mA(g)+nB(g) D.图四所示图中的阴影部分面积的含义是(v正-v逆) |
|
| 7. 实验题 | 详细信息 | ||||||||||||
碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色粉末状晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题: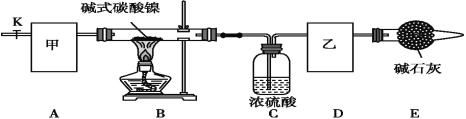 (1)甲、乙两装置可分别选取下列装置__________、__________(填字母,装置可重复选取)。  (2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中__________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气,其目的是__________。 (3)装置A的作用是__________,装置E的作用是__________。 (4)实验前后测得下表所示数据:
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍的化学式为__________。 |
|||||||||||||
| 8. | 详细信息 |
阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示: (1)电解饱和食盐水的化学方程式为____________。 (2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。 a.Na2SO4b.NaNO3 c.热空气吹出d.降低阳极区液面上方的气压 (3)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为 ①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:_______________________。 ②请写出NaIO3被氧化为NaIO4的离子反应方程式为________________________。 (4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。  ①结合化学用语解释10min时不同pH体系吸光度不同的原因:__________________。 ②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因____________________。 ③研究表明食盐水中I-含量≤0.2mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47mg•L-1的食盐水进行处理,为达到使用标准,理论上至少需要0.05mol•L-1NaClO溶液_____________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计) |
|
| 9. 综合题 | 详细信息 |
|
大气中CO2含量的增加会加剧温室效应,秉承“低碳环保,绿色出行”的生活理念,CO2的综合利用也成为热门研究领域。 I.CO2可用于生产乙烯。 (1)依据图1写出CO2和H2生成C2H4和H2O(l)的热化学方程式________。  (2)以稀硫酸作电解质溶液,利用电解法将CO2转化为乙烯的装置如图2所示。M电极的电极反应式为_____,工作一段时间后,阳极室中溶液的pH_____(填“增大”“不变”或“减小”)。 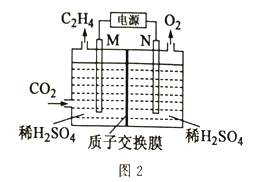 Ⅱ.CO2与H2在一定条件下可生产二甲醚:2CO2(g)+6H2(g) (3)在2.0L恒容密闭容器中,加入2.0molCO2和6.0molH2,恒温条件下经过5min达到平衡状态,此时的压强是起始压强的2/3 ①0~5min内反应的平均速率v(H2)=____,此温度下的平衡常数K=______. ②平衡常数K(800K)______K(900K)(填“>”“=”或“<”) (4)分别以Cat.1和Cat.2作催化剂发生该反应,反应进行相同的时间后,测得CO2的转化率a(CO2)随反应温度T的变化情况如图3所示(忽略温度对催化剂活性的影响)。 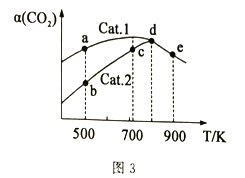 ①该反应的活化能Ea(Cat.1)________Ea(Cat.2)(填“>”或“<”)。 ②a、b、c、d、e五个状态中一定是平衡状态的是_______(填字母)。 |
|
| 10. | 详细信息 | ||||||||
|
氢能被视为最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。请回答下列问题: Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。 (1)基态B原子的价电子排布式为__________,B、C、N、O第一电离能由大到小的顺序为__________,CH4、H2O、CO2的键角按照由大到小的顺序排列为__________。 (2)与(HB=NH)3互为等电子体的有机分子为__________(填分子式)。 Ⅱ.氢气的安全贮存和运输是氢能应用的关键。 (1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图),每个杂环平面上下两侧最多可吸附10个H2分子。 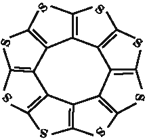 ①C16S8分子中C原子和S原子的杂化轨道类型分别为__________。 ②相关键长数据如表所示:
从表中数据看出,C16S8中碳硫键键长介于C-S键与C=S键之间,原因可能是__________。 |
|||||||||
| 11. 推断题 | 详细信息 |
醇酸树脂合成技术成熟、原料易得、涂膜的综合性能良好,是涂料用合成树脂中用量最大、用途最广的品种之一,新型环保醉酸树脂的合成线路如图所示: (1)E的化学名称是______, D中官能团的名称是____________。 (2)反应①的有机反应类型是_________。 (3)下列说法正确的是_________(填字母编号)。 a.化合物A的核磁共振氢谱有3组峰 b.油脂、蔗糖、麦芽糖酸性水解都能得到2种物质 c. 检验B中所含官能团时,加试剂的顺序依次是过氢量氧化钠溶液、硝酸银溶液 d. 1molC 与足量的银氨溶液反应能生成4 mol Ag e. 1molE 与足童的金属钠反应产生33.6L H2 (标准状况下) (4)写出C (5)在Cu 作催化剂,F(C8H10O2)与O2生成C,则F的同分异构体中,符合下列条件的芳香族化合物的结构简式有___________。 a.遇FeCl3溶液发生显色反应; b.发生消去反应后生成的化合物核磁共振氢谱有5组峰; (6)已知:RCH3CH=CH2 |
|
最近更新