2018年至2019年高二下半期开学考试化学试卷完整版(辽宁省鞍山市第一中学)
| 1. 选择题 | 详细信息 |
|
对于可逆反应A (g)+2B(g) A. 升高温度 B. 增大A的浓度 C. 减少C的浓度 D. 增大压强 |
|
| 2. 选择题 | 详细信息 |
|
下列不能用勒夏特列原理解释的事实是( ) A.棕红色的NO2加压后颜色先变深后变浅 B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 C.黄绿色的氯水光照后颜色变浅 D.合成氨工业使用高压以提高氨的产量 |
|
| 3. 选择题 | 详细信息 |
对于可逆反应N2(g)+3H2(g)  A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响 C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响 |
|
| 4. 选择题 | 详细信息 | ||||||||||
|
N2O5是一种新型硝化剂,在一定温度下可发生下列反应: 2N2O5(g)
|
|||||||||||
| 5. 选择题 | 详细信息 |
|
常温时,下列三种溶液: ①0.001 mol·L-1氨水与0.001 mol·L-1 HCl溶液等体积混合液 ②pH=3的HCl与pH=11的NaOH溶液等体积混合液 ③pH=11的氨水与pH=3的HCl溶液等体积混合液。 其pH大小关系正确的是( ) A.①=②=③ B.①>②=③ C.①<②=③ D.①<②<③ |
|
| 6. 选择题 | 详细信息 |
|
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,再用酸除去。下列说法不正确的是 A. CaCO3的溶解度小于CaSO4 B. 沉淀转化的实质是沉淀溶解平衡的移动 C. 沉淀转化的难易与溶解度差别的大小无关 D. CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
|
| 7. 选择题 | 详细信息 |
乙醇分子结构式如图所示,下列反应及断键部位不正确的是( ) A. 乙醇与钠的反应是① 键断裂 B. 乙醇的催化氧化反应是②③键断裂 C. 乙醇燃烧反应是全部键断裂 D. 乙醇与乙酸发生酯化反应是①键断裂 |
|
| 8. 选择题 | 详细信息 |
|
将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( ) A. 生成的乙酸乙酯中含有18O B. 生成的水分子中不含有18O C. 可能生成88 g乙酸乙酯 D. 可能生成90 g乙酸乙酯 |
|
| 9. 选择题 | 详细信息 |
|
相同温度下,等物质的量浓度的下列溶液中,pH最小的是 A. NH4Cl B. NH4HCO3 C. NH4HSO4 D. (NH4)2SO4 |
|
| 10. 选择题 | 详细信息 |
|
常温下,下列各种情况下一定能大量共存的离子组为( ) A. B. 由水电离出的 C. D. 无色溶液中: |
|
| 11. 选择题 | 详细信息 |
|
下列化学用语正确的是( ) A. 羟基的电子式: C. 四氯化碳分子比例模型:  D. 丙烷分子的比例模型: D. 丙烷分子的比例模型: |
|
| 12. 选择题 | 详细信息 |
|
下列各组物质中,可以用分液漏斗分离的是 A.酒精与汽油 B.溴苯与溴乙烷 C.硝基苯与水 D.苯与硝基苯 |
|
| 13. 选择题 | 详细信息 |
|
准确移取 A. 滴定管用蒸馏水洗涤后,直接装入 B. 随着 C. 用甲基橙作指示剂 D. 滴定达終点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 |
|
| 14. 选择题 | 详细信息 |
|
把pH=3的H2SO4溶液和pH=10的NaOH溶液混合,两者恰好中和,则酸和碱的体积比应是( ) A. 10∶1 B. 1∶10 C. 1∶100 D. 1∶2 |
|
| 15. 选择题 | 详细信息 |
|
下列有机物命名正确的是( ) A. 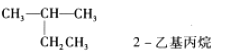 B. B.  C. |
|
| 16. 选择题 | 详细信息 |
|
满足分子式为C5H11Cl的有机物共有 A. 6种 B. 7种 C. 8种 D. 9种 |
|
| 17. 选择题 | 详细信息 |
三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中 加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1))中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )  A. 2NO2 B. NH4Cl溶于水时放出热量 C. 烧瓶(1)中平衡混合气的平均相对分子质量增大 D. 烧瓶(3)中气体的压强增大 |
|
| 18. | 详细信息 |
|
常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3。下列叙述正确的是( ) A. 该溶液中:c2(H+)≠c(H+)·c(A-)+Kw B. 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) C. 浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液中:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) D. 0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)===c(A-)+2c(OH-) |
|
| 19. 选择题 | 详细信息 |
在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是 A.H2R是二元弱酸,其Ka1=1×10-2 B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- ) C.NaHR在溶液中水解倾向大于电离倾向 D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
|
| 20. 计算题 | 详细信息 | ||||
|
(一)现有浓度均为 (1)若三种溶液中 (2)等体积的以上三种酸分别与过量的 (3)分别用以上三种酸中和一定量的 (4)分别与锌反应,开始时生成氢气的速率为 (二)有
|
|||||
| 21. 实验题 | 详细信息 |
化学上常用燃烧法确定有机物的组成.这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成.下图所列装置是用燃烧法确定有机物分子式常用的装置.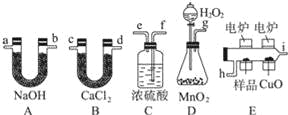 回答下列问题: (1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是 . (2)C装置中浓硫酸的作用是 . (3)D装置中MnO2的作用是 . (4)燃烧管中CuO的作用是 . (5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为 . (6)要确定该有机物的分子式,还要 . |
|
| 22. 综合题 | 详细信息 | ||||||||||||||||||||||||
二甲醚(
|
|||||||||||||||||||||||||




