2019届初三中考一模化学题开卷有益(江苏省宿迁市陈集初级中学)
| 1. | 详细信息 |
|
下列变化属于化学变化的是( ) A. 石蜡熔化 B. 潮湿的衣服被晒干了 C. 钢铁生锈 D. 水变成水蒸气 |
|
| 2. | 详细信息 |
|
下列实验操作中,正确的是( ) A.  稀释浓硫酸 B. 稀释浓硫酸 B.  测溶液的pH 测溶液的pHC.  称量固体 D. 称量固体 D.  加热液体 加热液体 |
|
| 3. | 详细信息 |
|
生活中处处是科学.下列是小胡同学的日常做法,其中合理的是( ) A. 住房装修好后立即入住 B. 用食醋清除热水瓶胆内壁的水垢 C. 日常饮食只按自己的喜好选择食品 D. 厨房有液体石油气泄漏,先打开排风机排气 |
|
| 4. | 详细信息 |
|
化学就在我们身边。以下认识不正确的是( ) A. 安全常识  B. 健康常识  C. 厨房中的化学  D. 家庭小实验  |
|
| 5. | 详细信息 |
|
下列有关金属的说法正确的是( ) A. 铝是地壳中含量最多金属元素,使用也最早 B. 焊锡的熔点比锡的熔点低,用于焊接金属 C. 不锈钢的抗腐蚀性强于纯铁,硬度小于纯铁 D. 铁在潮湿的空气中,表面会形成致密的氧化膜 |
|
| 6. | 详细信息 |
如图为KNO3、NaNO2(亚硝酸钠)、NaCl的溶解度曲线,下列说法正确的是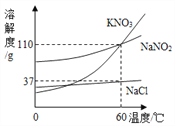 A. KNO3和NaNO2的溶解度相等 B. 60 ℃时,NaCl的饱和溶液的溶质质量分数为37% C. 将接近饱和的NaNO2溶液变为饱和溶液,可采用降温的方法 D. 除去NaCl中少量KNO3,可在较高温度下制得浓溶液再冷却结晶、过滤、干燥 |
|
| 7. | 详细信息 |
|
下列有关实验现象描述正确的是 A. 打开浓盐酸瓶塞,可看到大量白烟 B. 在面包上滴加加碘食盐水,呈蓝色 C. 点燃羊毛纤维能闻到烧焦羽毛气味 D. 电解水实验中负极产生的气体使带火星的木条复燃 |
|
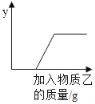
| 8. | 详细信息 | ||||||||||||||||||||
将足量物质乙加入物质甲中,加入物质乙的质量与纵坐标y的关系不能用如图所示曲线表示的是( )
|
|||||||||||||||||||||
| 9. | 详细信息 | |||||||||||||||
下列实验中,能够达到实验目的是( )
|
||||||||||||||||
| 10. | 详细信息 |
|
如图是某同学整理的铁及其化合物知识网络图。 (1)用数字和符号表示: ①金属铁中铁元素化合价_____ ②氯化铁中的阳离子_____。 (2)向少量铁锈中加入足量稀硫酸中,反应的现象是_____。 (3)暖宝宝中的主要成分是炭粉、铁粉、氯化钠,利用铁粉在空气中发生了缓慢氧化变成铁锈,而放出热量,其中氯化钠的作用为_____。 (4)服用FeSO4补充铁元素,可以预防_____(填序号)。 A 贫血 B 骨质疏松 C 甲状腺疾病 D 侏儒症 Fe (5)写出Fe3O4→Fe的化学反应方程式_____。 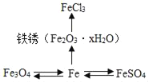 |
|
| 11. | 详细信息 |
|
初中化学学习中,我们初步认识了物质的微观结构. (1)氯化钾、二氧化硫、黄金三种物质中,由离子构成的物质是_____. (2) 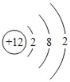 是某粒子的结构示意图,该粒子在化学反应中容易_____电子(填“得到”或“失去”). 是某粒子的结构示意图,该粒子在化学反应中容易_____电子(填“得到”或“失去”).(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是_____(填序号).  a.①②b.②③c.③④d.④⑤ |
|
| 12. | 详细信息 |
|
从海水中可以提取镁,其中的一个步骤是将卤水(含MgCl2、NaCl、KCl的混合液)转化为氯化镁晶体.实验室中模拟该转化的过程如下,回答有关问题. (1)制备氢氧化镁:向卤水中加入适量生石灰,充分反应后过滤. ①生石灰的主要成分为(填化学式)_____.该过程中发生了多个反应,其中会大量放热的反应是(填化学方程式)_____. ②过滤操作需用到的玻璃仪器除烧杯外,还有_____. (2)制备氯化镁溶液:用盐酸溶解Mg(OH)2.为了便于后续操作,盐酸不宜过量. ①反应的化学方程式是_____. ②通过计算,可准确知道所需盐酸的量.理论上溶解5.8g Mg(OH)2需要36.5% HCl溶液_____g. ③由于准确称量Mg(OH)2的步骤繁琐,实验中并不常用,而是通过一定操作方法来达到控制盐酸用量的目的.操作方法是:将Mg(OH)2加入烧杯中,_____,直到Mg(OH)2完全溶解为止. (3)制备氯化镁晶体:蒸发浓缩MgCl2溶液,冷却结晶. |
|
| 13. | 详细信息 |
下图是实验室制取二氧化碳并验证其性质的的实验装置图,试根据要求回答下列问题: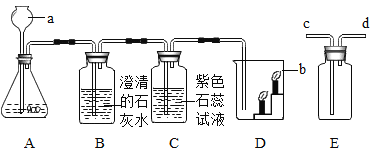 (1)装置C中观察到的现象是_______________,反应表达式是___________________。 (2)装置D中观察到蜡烛___________,说明_______________、_________________,由此可知,二氧化碳的用途之一可用于__________。 (3)用装置E来收集二氧化碳时,二氧化碳应从______(填“c端”或“d端”,下同)通入。若E装置事先装满水,用来收集氧气时,气体应从__________通入。 |
|
| 14. | 详细信息 |
|
实验课上,老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种,为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。 (己知氧化铁不溶于水,可溶于稀盐酸,生成氯化铁和水,溶液呈黄色) (提出猜想)甲组:铜粉; 乙组:铜粉和氧化铁粉末;丙组:_____。 (设计实验)方案1:取少量红色粉末放入试管中,滴加足量的_____并振荡,若甲组猜想正确,则实验现象为_____。 方案2:取8g红色粉末放入硬质玻璃管中,先通入CO,然后用酒精喷灯加热一段时间(实验装置如图所 示),停止加热并继续通入CO至装置冷却。 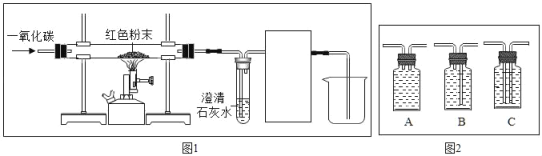 若乙组或丙组猜想正确,则试管内发生反应的化学方程式是_____。 实验时要先通CO再加热的原因是_____。实验结束是否需要将导管从澄清石灰水中取出,说明原因_____。 按方案2进行实验,当观察到硬质玻璃管中_____,则乙组猜想正确;等装置完全冷却到室温,称得硬质玻璃管内剩余固体质量为mg,则m的取值范围是_____。 (实验反思)如图虚线框内的装置是用于吸收CO2,并收集CO:请从如图(广口瓶内均为氢氧化钠溶液)中选择最合适的装置_____(填序号)。 |
|
| 15. | 详细信息 |
某粗盐中除NaCl以外还含有少量杂质MgCl2,为了测定粗盐中MgCl2的质量分数。取固体样品50.0g完全溶解于150.0g水中,并向其中逐渐加入一定浓度的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如图所示: 注:发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl 请根据相关信息完成下列计算: (1)反应完全时,生成氢氧化镁的质量为_____g; (2)在粗盐中氯化镁的质量分数;_____ (3)恰好完全反应时得到的溶液中溶质的质量分数。_____ |
|
最近更新