吉林高二化学2018年上册期中考试试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
你认为下列行为中有悖于“节能减排,和谐发展”这一主题的是( ) A. 将煤进行气化处理,提高煤的综合利用效率 B. 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 C. 开发太阳能、水能、风能,可燃冰等新能源,减少使用煤、石油等化石燃料 D. 实现资源的“3R”利用观,即减少资源消耗,增加资源的重复使用、资源的循环再生 |
|
| 2. 选择题 | 详细信息 |
|
下列变化中属于吸热反应的是 ①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释 ④Ba(OH)2·8H2O与NH4Cl反应 ⑤生石灰跟水反应生成熟石灰 A. ①④ B. ②③ C. ①④⑤ D. ②④ |
|
| 3. 选择题 | 详细信息 |
|
已知:4NH3+5O2=4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系正确的是 A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 3v(NH3)=2v(H2O) D. 5v(O2)=4v(NO) |
|
| 4. 选择题 | 详细信息 |
|
下列关于能量变化的说法,正确的是( ) A. 将等质量的红磷和白磷完全燃烧生成P2O3(s)放出热量相同 B. 2Na+ 2H2O= 2NaOH+H2 该反应生成物的总能量高于反应物的总能量 C. 放热反应中,反应物的总能量大于生成物的总能量 D. 有化学键断裂的是吸热过程,并且一定发生了化学变化 |
|
| 5. 选择题 | 详细信息 |
|
在反应3H2 + N2 A. 0.44s B. 1s C. 2s D. 0.33s |
|
| 6. 选择题 | 详细信息 |
|
下列关于热化学反应的描述中正确的是 A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol−1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1 B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol−1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol−1 C. 已知:500℃、30MPa下,N2(g)+3H2(g) D. CO(g)的燃烧热是283.0kJ·mol−1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1 |
|
| 7. 选择题 | 详细信息 |
|
某反应CH3OH(l)+NH3(g) =CH3NH2(g)+H2O(g)在高温度时才能自发进行,则该反应过程的△H、△S判断正确的是 A. △H > 0、△S < 0 B. △H < 0、△S > 0 C. △H < 0、△S < 0 D. △H > 0、△S > 0 |
|
| 8. 选择题 | 详细信息 |
|
下列有关说法正确的是 A. 铁片与稀盐酸制取氢气时,加入Na2SO4固体或NaNO3固体都不影响生成氢气的速率 B. 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 C. 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 D. 升高温度后,吸热反应的速率加快,放热反应的速率减慢 |
|
| 9. 选择题 | 详细信息 |
一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)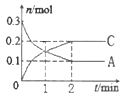 A. x=1 B. 反应进行到1min时,反应体系达到化学平衡状态 C. 2min后,A的正反应速率一定等于C的逆反应速率 D. 2min后,容器中A与B的物质的量之比一定为2∶1 |
|
| 10. 选择题 | 详细信息 |
用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是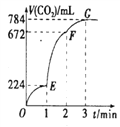 A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min) B. OE段表示的平均速率最快 C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7 D. F点收集到的CO2的量最多 |
|
| 11. 选择题 | 详细信息 |
|
反应C(s)+H2O(g) A. 增加少量的C B. 保持压强不变,充入N2使容器体积增大 C. 保持体积不变,充入H2使体系压强增大 D. 将容器的体积缩小为原来的一半 |
|
| 12. 选择题 | 详细信息 |
|
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2 A. 达到化学平衡时,正反应和逆反应的速率都为零 B. 当符合:3正N2=正H2时,反应达到平衡状态 C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2 D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态 |
|
| 13. 选择题 | 详细信息 |
|
将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g) A. 当A、B、C物质的量浓度之比为2︰1︰2时,反应即达到平衡状态 B. 4s内用物质B表示的反应速率为0.075 mol•L-1•s-1 C. 达平衡后若通入一定量氦气,A的转化率降低 D. 达平衡后若升高温度,C的浓度将增大 |
|
| 14. 选择题 | 详细信息 |
下列各表述正确的是( )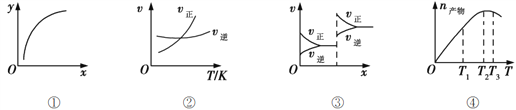 A. 图①表示在恒容容器中MgSO4(s) + CO(g) B. 图②表示其他条件一定时,反应A(g)+3B(g) C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况 D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g) |
|
| 15. 选择题 | 详细信息 | |||||||||||||||||||||||
某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应: H2(g)+I2(g)
|
||||||||||||||||||||||||
| 16. 计算题 | 详细信息 |
向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答: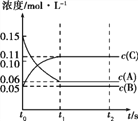 (1)密闭容器的体积是_____L; (2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______; (3)写出反应的化学方程式:________________________; (4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”); (5)B的起始的物质的量是_____; (6)平衡时体系内的压强为初始状态的___________倍。 |
|
| 17. 填空题 | 详细信息 |
|
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知: ①CO(g)+0.5O2(g) ②S(s)+O2(g) 则处理CO、SO2的方法的热化学方程式是________________________________。 (2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知: CO(g)+NO2(g) 2CO(g)+2NO(g) 若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。 (3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如: CH4(g)+4NO2(g) CH4(g)+4NO(g) 若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。 (4)已知下列热化学方程式: ①H2(g)+0.5O2(g) ②H2(g)+0.5O2(g) 则H2的燃烧热(△H)为________________________。 |
|
| 18. 填空题 | 详细信息 |
|
300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) (1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。 (2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。 (3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。 (4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。 |
|
| 19. 计算题 | 详细信息 |
|
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2 (1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。 计算:①a的值; ②用H2浓度的变化表示的反应速率。 (2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。 计算:上述温度下该反应的化学平衡常数。 |
|
最近更新



