2019-2020年高二上册期中考试化学试卷(宁夏银川一中)
| 1. 选择题 | 详细信息 |
|
“保护地球,人人有责”。开发新能源,倡导低碳经济对环境保护有重要的意义与作用。下列说法不正确的是( ) A.CO2、甲烷都属于温室气体 B.太阳能、风能和生物能均属于新能源 C.太阳能电池可将太阳能直接转化为电能 D.用甘蔗生产的乙醇燃料属于可再生能源,利用乙醇燃料不会产生温室气体 |
|
| 2. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
|
|||||||||||||||||||||||||||||||
| 3. 选择题 | 详细信息 |
|
下列各式中,属于正确的电离方程式的是 ( ) A.H2CO3 C.NaHSO4(熔融)=Na++H+ +SO42- D.NH4++H2O |
|
| 4. 选择题 | 详细信息 |
H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是: 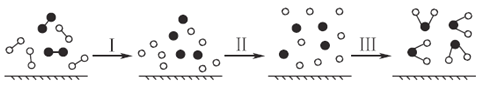 A. 过程Ⅰ是吸热过程 B. 该反应过程所有旧化学键都断裂,且形成了新化学键 C. 过程Ⅲ一定是放热过程 D. 该反应的能量转化形式只能以热能的形式进行 |
|
| 5. 选择题 | 详细信息 |
|
下列事实中不能说明亚硝酸是弱电解质的是( ) A.导电能力比盐酸弱 B.常温下,0.1mol・L-1 HNO2的pH>1 C.同体积、同物质的量浓度的HNO2和HCl加水稀释至pH相同时,HNO2加入的水少 D.常温下,0.1mol・L-1亚硝酸钠溶液的pH值约为9 |
|
| 6. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 B.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 C.25℃、101kPa时,1molS和2molS的燃烧热相等 D.1mol硫酸与1molBa(OH)2完全中和所放出的热量为中和热 |
|
| 7. 选择题 | 详细信息 |
白磷与氧气可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ/mol、P—O bkJ/mol、P=O ckJ/mol、O=O dkJ/mol,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( ) A.(6a+5d-4c-6b)kJ/mol B.(4c+6b-6a-5d)kJ/mol C.(6a+5d-4c-12b)kJ/mol D.(4c+12b-6a-5d)kJ/mol |
|
| 8. 选择题 | 详细信息 |
|
下列说法正确的是( ) A. 二氧化碳溶于水能部分电离,故二氧化碳属于电解质。 B. 硫酸钡难溶于水,但硫酸钡属于强电解质。 C. 氯化钠溶液在电流作用下完全电离成钠离子和氯离子。 D. . 强电解质溶液的导电性一定比弱电解质溶液的导电性强。 |
|
| 9. 选择题 | 详细信息 |
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。下列说法正确的是( ) A.如图条件下实验过程中没有热量损失 B.图中实验装置缺少环形玻璃搅拌棒 C.烧杯间填满碎纸条的作用是固定小烧杯 D.若改用60mL0.50mol/L盐酸与50mL0.55mol/L的NaOH溶液进行反应,从理论上说所测反应热数值是相等的 |
|
| 10. 选择题 | 详细信息 |
|
下列说法中正确的是( ) A.不存在活化能为0的反应 B.对于反应COCl2(g) C.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增加 D.加入适宜的催化剂,能改变反应历程,降低反应的活化能,增大平衡转化率 |
|
| 11. 选择题 | 详细信息 |
|
已知:6g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,且:C(s)+O2(g)=CO(g) ΔH=-110.35kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1。与6g碳完全燃烧相比,损失的热量为( ) A.56.51kJ B.110.35kJ C.196.46kJ D.282.57kJ |
|
| 12. 选择题 | 详细信息 |
|
足量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( ) ①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用50mL0.01mol/L的稀硫酸 A.①④⑤ B.②④⑤ C.③⑥⑦ D.⑥⑦⑧ |
|
| 13. 选择题 | 详细信息 |
|
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) A.2v(NH3)=v(CO2) B.密闭容器中混合气体的总质量不变 C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变 |
|
| 14. 选择题 | 详细信息 |
|
在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g) A. x+y>z+m B. B的转化率一定减小 C. 平衡向正反应方向移动 D. 混合气体的密度一定减小 |
|
| 15. 选择题 | 详细信息 |
|
对于可逆反应2AB3(g) A.  B. B. C.  D. D. |
|
| 16. 选择题 | 详细信息 |
|
下列叙述中,不能用勒夏特列原理解释的是( ) A.红棕色的NO2,加压后颜色先变深后变浅 B.滴加酚酞的氨水中加入氯化铵固体后红色变浅 C.煅烧粉粹的硫铁矿有利于SO2的生成 D.黄绿色的氯水光照后颜色变浅 |
|
| 17. 选择题 | 详细信息 |
|
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3kJ/mol,在常温常压下该反应能自发进行,对反应的方向起决定作用的是( ) A.温度 B.压强 C.焓变 D.熵变 |
|
| 18. 选择题 | 详细信息 |
在不同温度下,水达到电离平衡时c(H+)与c(OH﹣)的关系如图所示。100℃时,将0.1mol·L-1的HCl溶液和0.06mol·L-1的Ba(OH)2溶液等体积混合后,该溶液的pH是( ) A.1.7 B.2 C.10 D.10.3 |
|
| 19. 选择题 | 详细信息 |
|
25℃时,在下列给定条件的溶液中,一定能大量共存的离子组是( ) A.pH=7的溶液中:Fe3+、NO3-、SO42-、Na+ B.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN- C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- D.由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
|
| 20. 选择题 | 详细信息 |
|
下列实验符合要求的是( ) A.酸碱中和滴定时,锥形瓶经蒸馏水洗净后,即可直接注入待测液进行滴定 B.酚酞在pH=10的溶液中是无色的 C.若25mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定等于15mL D.用玻璃棒蘸取溶液滴在表面皿上的润湿的pH试纸上,测得其pH为12 |
|
| 21. 选择题 | 详细信息 |
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+ CO2(g)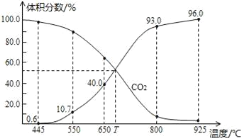 A.0.27P总 B.0.67P总 C.0.90P总 D.1.50P总 |
|
| 22. 选择题 | 详细信息 |
|
下列有关电解质及其溶液的叙述正确的是( ) A.向0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中所有离子浓度均减小 B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 C.向0.10mol·L-1的氨水中加入少量硫酸铵固体,则溶液中NH3·H2O的电离度增大 D.室温下,pH=11的NaOH溶液和pH=3的醋酸溶液等体积混合后,滴入石蕊试液溶液呈红色 |
|
| 23. 选择题 | 详细信息 |
常温下,向10.00mL0.1000mol·L-1 HA溶液中逐滴加入0.1000mol·L-1NaOH溶液的pH与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( ) A.HA溶液的电离方程式为HA B.恰好完全反应的点是c点 C.整个滴定过程中水的电离程度先增大后减小 D.点d所示溶液中:c(Na+)+c(H+)=c(OH-)+c(A-) |
|
| 24. 选择题 | 详细信息 | |||||||||||||||||||||||||||||||||||||
某探究性学习小组利用H2C2O4溶液与酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验如表所示,下列有关说法中正确的是( )
|
||||||||||||||||||||||||||||||||||||||
| 25. 选择题 | 详细信息 |
|
常温下,向a mol/L某弱酸HA溶液中滴加等体积的b mol/L氢氧化钠溶液恰好使溶液呈中性。则该温度下,HA的电离平衡常数表达式是( ) A. |
|
| 26. 实验题 | 详细信息 | ||||||||||||||||||
|
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上 ②固定好滴定管并使滴定管尖嘴充满液体 ③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数 ④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液 ⑤用标准液滴定至终点,记下滴定管液面读数 请回答: (1)以上步骤有错误的是___(填编号),该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。 (2)实验中用左手控制___,眼睛注视___,直至滴定终点。判断滴定终点的现象是:锥形瓶中溶液___。 (3)如图是某次滴定时的滴定管中的液面,其读数为___mL。  (4)根据下列数据:请计算待测盐酸溶液的浓度为___mol/L。
|
|||||||||||||||||||
| 27. 填空题 | 详细信息 |
|
常温下,现有5种溶液:①0.1mol/L稀硫酸②0.1mol/L稀醋酸③pH=1的稀硫酸④pH=1的稀盐酸⑤pH=1的稀醋酸 (1)若等质量、等体积的锌粒在相同条件下与上述5种溶液反应,开始产生氢气速率最快的是___(填序号,下同)。 (2)若等体积的②、③、④、⑤溶液分别与足量的锌粒完全反应,在相同条件下产生氢气体积由大到小的排序是___。 (3)若等体积的①、②、③、④溶液分别与等浓度的氢氧化钠溶液恰好完全中和,消耗氢氧化钠溶液体积由小到大的排序是___。 |
|
| 28. 填空题 | 详细信息 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(V/V0)的变化如图所示。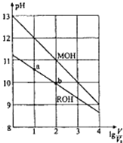 (1)MOH是___(填“强碱”或“弱碱”)。 (2)写出ROH的电离方程式___。 (3)若溶液体积相等,为了使MOH溶液与ROH溶液稀释后pH相等,加入水较多的是___。 (4)常温下,在ROH溶液中加蒸馏水稀释,下列物理量变大的是___。 A.Kw B. (5)ROH的电离程度:b点___a点(填“大于”、“小于”或“等于”,下同);若无限稀释MOH、ROH溶液,最终溶液的pH:MOH溶液___ROH溶液。 |
|
| 29. 综合题 | 详细信息 | |||||||||||||||||||||||||
|
丙烷、乙烯等有机物在工业上有广泛的应用,回答下列问题: (1)已知:①C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H1 ②C(石墨,s)+O2(g)= CO2(g) △H2 ③2H2(g)+O2(g)= 2H2O(l) △H3 写出丙烷气体(C3H8)分解得到石墨(C)和氢气的热化学方程式:___。 (2)煤制乙烯包括合成气制备、合成气制甲醇、甲醇分解三步,则: ①生产合成气的反应:C(s)+H2O(g)=CO(g)+H2(g)在高温下能自发进行,则该反应的___(填选项)。 a.△H>0 △S>0 b.△H>0 △S<0 c.△H<0 △S>0 d.△H>0 △S<0 ②用合成气制备甲醇的反应为:CO(g)+ 2H2(g)
|
||||||||||||||||||||||||||




