湖南省长沙市长郡中学2021届高三前半期第5次月考化学题带答案和解析
| 1. 选择题 | 详细信息 |
|
下列说法不正确的是 A.正在开展垃圾分类工作,将易腐垃圾转化成热值较高的可燃性气体,属于生物质能的热化学转换 B.嫦娥五号上使用的碳纤维被誉为“新材料之王”,是一种新型有机高分子材料 C.嫦娥五号上升起的“高科技国旗”具有“耐热性,耐高低温、抗静电”等特点,它是以高性能芳纶纤维材料为主的复合材料燃烧后没有烧焦羽毛的气味 D.硅、砷化镓、氮化镓都是半导体材料 |
|
| 2. 选择题 | 详细信息 |
|
2019年,我国青年化学家雷晓光被遴选为“青年化学家元素周期表”氮元素的代言人。下列与氮元素有关的说法正确的是 A. C. |
|
| 3. 选择题 | 详细信息 |
|
下列有关化学用语表示正确的是 A.  B.聚丙烯的结构简式: C.丙烷分子的比例模型:  D.2-乙基-1,3-丁二烯分子的键线式:  |
|
| 4. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是 A.0.1mol的 B.0℃、101kPa下,0.1mol乙炔和甲醛(HCHO)的混合物中含有 C.将1mol D.常温下, |
|
| 5. 选择题 | 详细信息 |
|
下列离子方程式书写错误的是 A.氢氧化铁溶于氢碘酸(强酸) B.标准状况下将112 mL氯气通入 C.等物质的量 D. |
|
| 6. 选择题 | 详细信息 |
将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是( ) A.过程①发生复分解反应,由弱酸反应得到强酸 B.过程②中,发生反应的离子方程式为: S2-+2Fe3+=S+2Fe2+ C.过程③中,标准状况下11.2L O2参加反应转移2mol电子 D.在②中Fe3+作氧化剂,在③中Fe3+是氧化产物 |
|
| 7. 选择题 | 详细信息 |
一篇关于合成“纳米小人”的文章成为有机化学史上最受欢迎的文章之一、其中涉及到的一个反应为: 下列说法中正确的是 A.该反应的原子利用率为100% B.化合物M的一氯代物有4种 C.化合物N中的17个碳原子一定共平面 D.化合物P能使酸性KMnO4溶液褪色,但不能使溴水褪色 |
|
| 8. 选择题 | 详细信息 |
下列实验操作能达到实验目的的是( ) A.用图Ⅰ装置验证SO2的漂白性 B.用图Ⅱ装置制取NaHCO3固体 C.用图Ⅲ装置收集NO2 D.用图Ⅳ装置制备Fe2(SO4)3晶体 |
|
| 9. 选择题 | 详细信息 |
化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是 A.非金属性:X<Z<W B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点 C.化合物甲中除Q外,其它原子均满足8电子稳定结构 D.0.1 mol•L-1 最高价氧化物对应水化物的酸性:Y> Z |
|
| 10. 选择题 | 详细信息 |
|
白磷的性质不太稳定,与过量氢氧化钠溶液反应,会歧化生成磷化氢与次磷酸钠, A. B. C. D.气体中混有 |
|
| 11. 选择题 | 详细信息 |
肼( A.温度较低时,肼和氧气主要发生反应: B.900℃时,能发生 C.900℃时, D.该探究方案是将一定量的肼和氧气在密闭容器中进行不断升温实验 |
|
| 12. 选择题 | 详细信息 |
一种以海绵铜(Cu)为原料制备CuCl的工艺流程如下。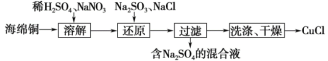 已知:CuCl为白色粉末,微溶于水,不溶于乙醇,在潮湿的空气中易被氧化。下列说法错误的是 A.“溶解”时可用热空气或H2O2代替NaNO3 B.“过滤”用到的玻璃仪器有漏斗、烧杯、玻璃棒 C.“还原”时发生的离子反应为2Cu2++ D.为提高CuCl的产率和纯度,可采用乙醇洗涤、真空干燥 |
|
| 13. 选择题 | 详细信息 |
已知:常温下, A.曲线 B. C.将浓度均为 D.含 |
|
| 14. 选择题 | 详细信息 |
磷酸铁锂动力电池( A.放电时, B.在充电时,正极中的Li+通过聚合物隔膜向负极迁移 C.放电时,正极反应式为 D.若用该电池电解精炼铜,阴极质量增重19.2kg时,则电池中通过聚合物隔膜的 |
|
| 15. 选择题 | 详细信息 |
25℃时,向20 mL 0.1 mol/L HAuCl4溶液中滴加0.1 mol/L NaOH溶液,滴定曲线如图1所示,含氯微粒的物质的量分数(δ)随pH变化关系如图2所示,则下列说法不正确的是( ) A.图2中A点对应溶液的pH约为5 B.b点对应溶液中:c(Na+) >c(AuCl C.d点对应溶液中:c(OH-)-c(H+)=c(HAuCl4) D.滴定过程中,n(HAuCl4)与n(AuCl |
|
| 16. 选择题 | 详细信息 |
|
已知:Cu2O+H2SO4 = Cu+CuSO4 +H2O 。某红色粉末样品可能含有 Fe2O3 和 Cu2O 中的一种或两种,为探究其组成,取少量样品加入过量稀硫酸。下列有关说法正确的是 A.若固体全部溶解,则发生的离子反应只有:Fe2O3+6H+=2Fe3+ +3H2O B.若固体部分溶解,则样品中一定含有 Cu2O,一定不含有 Fe2O3 C.若固体全部溶解,再滴加 KSCN 溶液,溶液不变红色,则样品中 n(Fe2O3):n(Cu2O)为 2:1 D.另取 ag 样品在空气中充分加热至质量不再变化,称其质量为 b g(b>a),则混合物中 Cu2O 的质量分数为 9(b-a)/a |
|
| 17. 填空题 | 详细信息 | ||||||
过硫酸(H2S2O8)是一种强酸,为无色晶体,易溶于水,在热水中易水解。过硫酸和过硫酸盐在工业上均可用作氧化剂。
(1)根据硫酸和过硫酸的结构式,可判断下列说法正确的是___________(填标号)。 |
|||||||
| 18. | 详细信息 | ||||||||||||||||
叠氨化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。下面是工业水合肼法制备叠氮化钠的工艺流程: 已知
请回答: |
|||||||||||||||||
| 19. | 详细信息 | ||||||||||||
|
(1)
由此计算 |
|||||||||||||
| 20. | 详细信息 |
有机物I可作为高分子沈膨强胀剂,工业上一种合成路线图如下: 已知:①H中仅有一-种官能团 ②RCN ③ 回答下列问题: (1) A中官能团的名称为___________。 (2) C的结构简式为___________。 (3)下列说法正确的是___________。 A.有机物B、C、D均能与金属钠反应 B.有机物H可以发生氧化、还原、消去反应 C.有机物I的分子式为C25H32O6 D.由A生成E的反应、由C生成D的反应均为取代反应 (4)写出D、E和F生成G的反应方程式___________。 (5)写出符合下列条件的有机物G的四种同分异构体的结构简式___________。 ①核磁共振氢谱显示有4种氢 ②能发生银镜反应,并且l mol G能与3 mol NaOH反应 ③除苯环外不含其它环 (6)已知: 设计以1,3-丁二烯和有机物D为原料合成  的合成路线___________。 的合成路线___________。 |
|
| 21. | 详细信息 |
|
铜及其化合物广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域。回答下列问题: (1)铜原子价层电子排布式为___________, (2)钾和铜都是第四周期元素,且原子的最外层电子数相同,铜的熔沸点远大于钾的原因是___________。 (3)在高温下,Cu2O比CuO稳定,从离子的电子层结构角度分析,其主要原因是___________。 (4) A.离子键B.极性键C.非极性键 D.配位键 E.氢键  (5)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为  ①原子B的坐标参数为___________; ②若该晶体密度为 |
|














