云南2020年高一化学后半期开学考试在线免费考试
| 1. 选择题 | 详细信息 | ||||||||
下列实验装能达到实验目的是
|
|||||||||
| 2. 选择题 | 详细信息 |
|
下列转化过程中必须加入还原剂的是 A. FeS→H2S B. SO2→SO32- C. Fe3+→Fe2+ D. Cu→Cu2+ |
|
| 3. 选择题 | 详细信息 |
|
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是 A. 钢铁生锈 B. 充有H2的“喜羊羊”娃娃遇明火发生爆炸 C. 食物腐败变质 D. 大理石雕像被酸雨腐蚀毁坏 |
|
| 4. 选择题 | 详细信息 |
|
在下列各溶液中,离子一定能大量共存的是 A. 强碱性溶液中:K+、Mg2+、Cl-、SO42- B. 在无色透明的溶液中:K+、Cu2+、NO3-、SO42- C. 含有0.1mol/LCa2+的溶液中:Na+、K+、CO32-、Cl- D. 室温下,强酸性溶液中:Na+、Fe3+、NO3-、SO42- |
|
| 5. 选择题 | 详细信息 |
|
每年10月23日上午6:02到晚上6:02被誉为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。用NA表示阿伏加德罗常数的值,下列说法中正确的是 A. 标准状况下,22.4L CCl4含有NA个CCl4分子 B. 1mol/L Mg(NO3)2溶液中含有NO3﹣的数目为2NA C. 等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等 D. 5.6g铁与足量盐酸反应转移的电子数为0.2NA |
|
| 6. 选择题 | 详细信息 |
|
下列表示物质变化的化学用语正确的是 A. NH3·H2O的电离方程式:NH3·H2O=NH4++OH- B. 稀硫酸溶液中滴加少量氢氧化钡溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O C. 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ D. 用盐酸除去混在铜粉中的少量铁粉杂质:6H+ + 2Fe=2Fe3++ 3H2↑ |
|
| 7. 选择题 | 详细信息 |
|
下列叙述正确的是( ) A. 碱金属性质相似,均为银白色(铯除外)的柔软金属,密度都比较小 B. 碱金属单质在空气中燃烧生成的都是过氧化物 C. 碱金属单质的熔沸点随原子序数的增加而升高 D. Li、Na、K都可以保存在煤油中 |
|
| 8. 选择题 | 详细信息 |
|
2019年是国际化学元素周期表年。下列有关元素周期表的说法正确的是( ) A. 最新的元素周期表有八个周期 B. 主族就是周期表中只有短周期元素的纵列 C. 一般在过渡元素中寻找一些化学反应新型催化剂 D. 元素周期表第8、9、10三纵列合称ⅧB族,是元素周期表中元素种类最多的族 |
|
| 9. 选择题 | 详细信息 |
|
A. C. |
|
| 10. 选择题 | 详细信息 |
|
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 A. X的气态氢化物比Y的稳定 B. W的最高价氧化物对应水化物的酸性比Z的强 C. Z的非金属性比Y的强 D. X与Y形成的化合物都易溶于水 |
|
| 11. 选择题 | 详细信息 |
|
短周期主族元素X、Y、Z、W、R的原子序数依次增大,X原子核外最外层电子数是次外层的3倍,X、W同主族,Y原子半径在同周期中最大,Z的M层电子数比K层多1。下列说法中正确的是( ) A. 最简单气态氢化物的沸点:X<W B. Y、Z、W最高价氧化物对应的水化物相互之间可发生反应 C. W氧化物对应的水化物是一种强酸 D. 最简单气态氢化物的热稳定性:W>R |
|
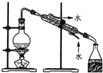
| 12. 实验题 | 详细信息 |
为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验(夹持仪器已略去,装置气密性已检验)。 实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)浸有NaOH溶液的棉花的作用____________________________。 (2)装置A中发生的置换反应的化学方程式为___________________。 (3)装置B的溶液中NaBr完全被氧化,则消耗Cl2的物质的量为__________。 (4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是__________。 |
|
| 13. 推断题 | 详细信息 | ||||||||||||||||||||||||||||||||||||
下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
|
|||||||||||||||||||||||||||||||||||||
| 14. 实验题 | 详细信息 |
|
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。 Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。 (2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。 Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。  (3)仪器A的名称为___________,干燥管D的作用为___________________。 (4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。 (5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。 |
|
最近更新