高一化学下册单元测试刷题练习
| 1. 选择题 | 详细信息 |
|
欲使明矾溶液中的铝离子完全沉淀下来,适宜的试剂是( ) A.氢氧化钠溶液 B.氢氧化钾溶液 C.氨水 D.盐酸 |
|
| 2. 选择题 | 详细信息 |
|
蛇纹石可以看作由氧化镁、氧化铝、二氧化硅、氧化铁组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入氢氧化钠溶液至过量。下列叙述不正确的是( ) A.沉淀X的成分是二氧化硅 B.将蛇纹石试样直接溶于过量的氢氧化钠溶液后过滤,可得到纯净的红色颜料氧化铁 C.在溶液Y中加入过量的氢氧化钠溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2 D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ |
|
| 3. 选择题 | 详细信息 |
|
复合材料的使用使导弹的射程有了很大的提高,其主要原因是( ) A.可以使导弹能经受超高温变化 B.可以使导弹质量减轻 C.可以使导弹承受超高强度的改变 D.可以使导弹承受温度的剧烈变化 |
|
| 4. 选择题 | 详细信息 |
|
下列各物质的溶液不能与二氧化碳反应的是( ) A.氯化铝 B.次氯酸钠 C.硅酸钠 D.碳酸钠 |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
下列物质性质与用途对应关系正确的是
|
||||||||||||||||
| 6. 选择题 | 详细信息 |
|
将Cu片放入0.1 mol·L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为 A. 3∶2 B. 3∶5 C. 4∶3 D. 3∶4 |
|
| 7. 选择题 | 详细信息 |
|
下列金属中,属于有色金属且在常温下不溶于浓硝酸的是( ) A.Fe B.Mg C.Al D.Cu |
|
| 8. 选择题 | 详细信息 |
|
能将太阳能转化为电能的材料是( ) A. 硅 B. 二氧化硅 C. 硅酸钠 D. 硅酸钙 |
|
| 9. 选择题 | 详细信息 |
|
从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是( ) A.地壳中金属元素的含量 B.金属的延展性 C.金属的导电性 D.金属活动性及冶炼的难易程度 |
|
| 10. 选择题 | 详细信息 |
|
下列说法中,正确的是( ) A.SiO2和CO2常温都是气体 B.CO2、SiO2均能和氢氟酸反应 C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 D.CO2、SiO2均可与水反应制得相应酸 |
|
| 11. 选择题 | 详细信息 |
|
用作医疗器械和炊具等的不锈钢,是在炼钢时加入了( ) A.碳 硫 B.硅 锰 C.镍 铬 D.硅 铬 |
|
| 12. 选择题 | 详细信息 |
|
下列有关硅酸盐及无机非金属材料的说法正确的是 A. 硅酸钠属于盐,不属于碱,所以硅酸钠水溶液可以保存在磨口玻璃塞试剂瓶中 B. 反应①Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2 C. 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料 D. 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2 |
|
| 13. 选择题 | 详细信息 |
|
某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案: 方案Ⅰ:铜铝混合物 方案Ⅱ:铜铝混合物 下列有关判断中不正确的是( ) A.溶液A和B均可以是盐酸或氢氧化钠溶液 B.溶液A和B均可以选用稀硝酸 C.若溶液B选用氯化铁溶液,则实验难以实现 D.实验方案Ⅱ更便于实施 |
|
| 14. 选择题 | 详细信息 |
|
下列物质中,不跟烧碱溶液反应的是( ) A.二氧化硅 B.二氧化碳 C.硅 D.碳 |
|
| 15. 选择题 | 详细信息 |
|
不锈钢通常不与酸、碱、盐反应,是因为加入了( ) A. Ni和Cr B. Ni和Au C. Cr和 Au D. Cr和Pt |
|
| 16. 解答题 | 详细信息 |
|
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验: ①取适量A进行铝热反应,产物中有单质B生成; ②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C; ③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B; ④用KSCN溶液检验时,溶液D不变色。 请填空: (1)①中引发铝热反应的实验操作是___________,产物中的单质B是________。 (2)②中所发生的各反应的化学方程式是___________。 (3)③中所发生的各反应的离子方程式是___________。 (4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。 |
|
| 17. 填空题 | 详细信息 | ||||||||||||||||||||||||||||
|
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填在表中相应的空格内。 可供选择的试剂:A.盐酸 B.NaOH溶液 C.O2 D.水 E.不用其他试剂 可选用的操作:①水洗 ②加热 ③过滤 ④结晶
|
|||||||||||||||||||||||||||||
| 18. 解答题 | 详细信息 |
|
相同物质的量的钠、镁、铝三种金属分别与足量的盐酸反应: (1)反应剧烈程度最大的是________; (2)完全反应后,产生氢气最多的是________; (3)相同条件下,三种金属产生氢气的体积比是______。 |
|
| 19. 解答题 | 详细信息 |
某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验: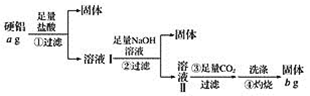 (1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。 (2)上述第③步反应中,生成沉淀的离子方程式为____________。 (3)该合金中铝的含量为__________。 |
|
| 20. 实验题 | 详细信息 | |||||||||||||||
实验室铝热反应的实验装置如下: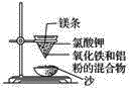 (1)下面放置盛细沙的____________(填名称)。 (2)镁条的作用是______________________________________。 (3)实验现象有: ①________________________________________________________________________; ②________________________________________________________________________; ③________________________________________________________________________。 (4)写出该反应的化学反应方程式:________________,在冶金工业上也常用这一反应原理来冶炼________。 A.不活泼金属 B.较活泼金属 C.稀有金属 D.高熔点金属 (5)已知下表数据:
|
||||||||||||||||
| 21. 实验题 | 详细信息 |
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾。其设计的实验过程为: (1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于___上(用以下所给仪器的编号填入,下同),取用坩埚应使___,灼烧后的坩埚应放在___上,不能直接放在桌面上。 a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹 (2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是___。 a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化 c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化 (3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、___、冷却结晶、___、自然干燥。 (4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是:____。 (5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果x值偏高,可能的原因是___。 a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化 |
|
| 22. 计算题 | 详细信息 |
|
现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。 (1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升? (2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升? |
|
| 23. 计算题 | 详细信息 |
|
钾玻璃中含有18.4%的K2O,11.0%的CaO,70.6%的SiO2。 (1)计算三种氧化物的物质的量之比_________。 (2)若需制造5.1 t 钾玻璃,需用碳酸钾、石灰石、石英各_________吨? (3)生产过程中释放出_________吨温室气体二氧化碳? |
|
| 24. 计算题 | 详细信息 |
| 已知普通玻璃的成分为Na2O∶13%,CaO∶11.7%,SiO2∶75.3%。某玻璃厂现有石灰石500 t,纯碱2 400 t。计算上述原料能生产普通玻璃_________吨? | |
最近更新



