重庆市第三十七中学校2021届高三9月月考化学在线测验完整版
| 1. 选择题 | 详细信息 |
|
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是 A.宋代《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜,该颜料耐酸耐碱 B.《本草纲月》中有如下记载:“火药乃焰硝(KNO3)、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中利用了KNO3的氧化性 C.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品 D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作 |
|
| 2. 选择题 | 详细信息 |
|
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”的做法并无不妥,甚至可以说并不是害人还是救人。这种做法利用的原理是( ) A.胶体的电泳 B.胶体的丁达尔现象 C.胶体的布朗运动 D.胶体的聚沉 |
|
| 3. 选择题 | 详细信息 |
|
下列有关物质的分类或归类正确的是( ) ①混合物:盐酸、福尔马林、铝热剂、聚乙烯 ②化合物:CaCl2、烧碱、硬脂酸、氯仿 ③电解质:胆矾、冰醋酸、冰水混合物、水玻璃 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同位素:H、D、T A.①③⑤ B.①②⑤ C.②③④ D.①⑤ |
|
| 4. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列说法正确的是( ) A.常温下,pH=11的NaOH溶液中由水电离出的H+数目为0.001NA B.56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3NA C.28g乙烯与C3H8的混合物中含有C—H键的数目为4NA D.标准状况下,含NA个分子的H2、CO混合气体的体积约为22.4L |
|
| 5. 选择题 | 详细信息 | ||||||||||||||||||||||||||
下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合只有
|
|||||||||||||||||||||||||||
| 6. 选择题 | 详细信息 |
|
宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2===2X+2H2O,下列说法不正确的是( ) A. X的化学式为Ag2S B. 银针验毒时,空气中氧气得到电子 C. 反应中Ag和H2S均是还原剂 D. 每生成1 mol X,反应转移2 mol e- |
|
| 7. 选择题 | 详细信息 |
|
对于下列实验,能正确描述其反应的离子方程式是: A.用Na2SiO3溶液通入过量CO2: B.向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- C.氢氧化钡溶液中加入少量NaHCO3溶液:Ba2++OH-+ D.NH4Al(SO4)2溶液中滴加过量的NaOH溶液: |
|
| 8. 选择题 | 详细信息 |
|
化学与生产生活密切相关。下列有关说法错误的是 A.可用胆矾晶体检验“无水乙醇”是否无水 B.84消毒液不能与洁厕灵(含盐酸)混合使用 C.晶体硅是芯片的关键材料,也是制太阳能电池的常用材料 D.服用补铁剂时(铁为+2价),加服具有还原性的维生素C效果更好 |
|
| 9. 选择题 | 详细信息 |
|
现有以下反应①Cl2+2KBr═2KCl+Br2,②KClO3+6HCl═3Cl2+KCl+3H2O,③2KBrO3+Cl2═Br2+2KClO3,下列说法正确的是.( ) A.上述三个反应都有单质生成,所以都是置换反应 B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 C.反应②中还原剂与氧化剂的物质的量之比为6:1 D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
|
| 10. 选择题 | 详细信息 | |||||||||||||||
下列根据实验操作和现象得出的结论正确的是
|
||||||||||||||||
| 11. 选择题 | 详细信息 |
某有机物结构简式如图,下列对该物质的叙述中正确的是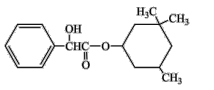 A.该有机物易溶于苯及水 B.该有机物苯环上的一氯代物共有4种 C.该有机物可以与溴的四氯化碳溶液发生加成反应使之褪色 D.1mol该有机物最多可与1mol NaOH发生反应 |
|
| 12. 选择题 | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是( ) A. SiO2熔点很高,可用于制造坩埚 B. NaOH能与盐酸反应,可用作制胃酸中和剂 C. Al(OH)3是两性氢氧化物,氢氧化铝胶体可用于净水 D. HCHO可以使蛋白质变性,可用于人体皮肤伤口消毒 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
|
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
某溶液中可能含有H+、Na+、NH A.原溶液中含阳离子H+、NH B.原溶液中一定含有SO C.原溶液中Fe3+和Al3+的物质的量之比为1:1 D.反应最后形成的溶液中含有的溶质为Na2SO4 |
|
| 15. | 详细信息 | ||||
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
某同学欲探究废水的组成,进行了如下实验: |
|||||
| 16. | 详细信息 | |||||||||||||||
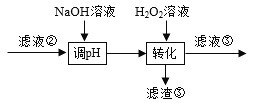
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其它不溶性物质。采用如图工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):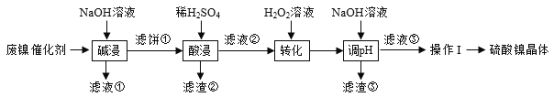 溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题: |
||||||||||||||||
| 17. 实验题 | 详细信息 |
|
Ⅰ.某厂废水中含KCN,其浓度为0.01 mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O (1)被氧化的元素是_______。(用元素符号表示) (2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:_______ ____KOCN+_______Cl2 +_____KOH→_______K2CO3+_____N2+_____KCl+_____H2O (3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气_______mol。 Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。 (4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。 (5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO (6)现取(3)中溶液20.00 mL,用a mol·L-1Na2S2O3溶液进行滴定,经过平行实验测得消耗Na2S2O3标准溶液b mL,计算废液中Cl2的浓度为_______mol·L-1(用含a、b的表达式表示)。 |
|
| 18. 实验题 | 详细信息 |
实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。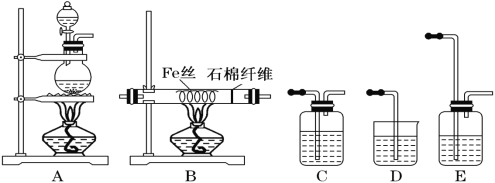 (1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):A→_______ → _______ → _______ → D。 (2)A装置烧瓶中反应的离子方程式是_______。 (3)E中盛装的试剂是_______,其作用是_______。 (4)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤: a.待B装置玻璃管冷却后,将管中物质用水溶解,_______ (填操作方法)除去不溶物; b.取少量滤液,滴加_______溶液,溶液呈现红色,以此检验Fe3+; c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。 (5)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)_______。你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液_______。 A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸 |
|
| 19. 推断题 | 详细信息 | ||||||||||||
已知T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表.
|
|||||||||||||
| 20. | 详细信息 |
甲氧基肉桂酸乙基己酯(下图中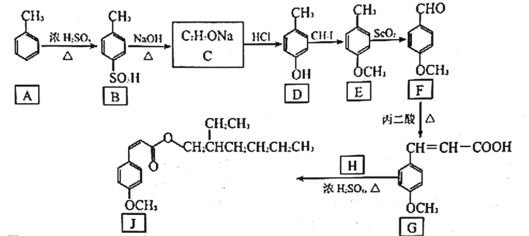 回答下列问题: (1) (2) (3) (4)  )。 )。①与 (5)以乙醇和丙二酸为原料合成聚巴豆酸乙酯 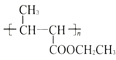 ,请补充完成以下合成路线(无机试剂可________ ,请补充完成以下合成路线(无机试剂可________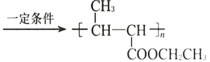 |
|