内蒙古北京八中乌兰察布分校2020-2021年高一上册期末考试化学在线考试题带答案和解析
| 1. 选择题 | 详细信息 |
|
对突发事件的处理彰显我们的学科知识和智慧。下列化学实验或事故的处理方法正确的是( ) A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硫酸 C.燃着的酒精灯不慎翻倒,灯内酒精流出并着火,可用水直接扑灭 D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
|
| 2. 选择题 | 详细信息 |
|
设阿伏加德罗常数的数值为NA,下列说法正确的是( ) A.2.4gMg粉与足量的盐酸反应失去电子数为0.2NA B.常温常压下,1L0.2mol/L MgCl2溶液中含Cl-数为0.2NA C.常温常压下,22.4L的氧气中含氧原子数为2 NA D.18gH2O含有的电子数8 NA |
|
| 3. 选择题 | 详细信息 |
|
某无色透明溶液,在酸性环境下能大量共存的离子组是( ) A.Na+、SO C.K+、MnO |
|
| 4. 选择题 | 详细信息 |
|
下列关于纯净物、混合物、电解质、非电解质的正确组合为( ) A.盐酸、水煤气、硫酸、干冰 B.蒸馏水、蔗糖溶液、氯化氢、二氧化硫 C.胆矾、盐酸、铁、碳酸钙 D.胆矾、水煤气、氯化铜、碳酸钠 |
|
| 5. 选择题 | 详细信息 |
|
下列反应的离子方程式书写正确的是( ) A. NaHSO4溶液中加入Ba(OH)2溶液后溶液恰好显中性:Ba2++OH-+H++SO42-===BaSO4↓+H2O B. 向澄清石灰水中通入过量CO2:OH-+CO2===HCO3- C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-==BaSO4↓ D. 碳酸钙与盐酸反应:CO32-+2H+===H2O+CO2↑ |
|
| 6. 选择题 | 详细信息 |
|
下列反应中属于氧化还原反应,但不属于四种基本反应类型的是 A.CuO + H2 C.Fe2O3 + 3CO |
|
| 7. 选择题 | 详细信息 |
|
下列反应可用离子方程式“H++OH-=H2O”表示的是( ) A.NaHSO4溶液与Ba(OH)2溶液混合 B.NH4Cl溶液与Ca(OH)2溶液混合 C.HNO3溶液与KOH溶液混合 D.CH3COOH溶液与NaOH溶液混合 |
|
| 8. 选择题 | 详细信息 |
|
关于反应2Na2O2+2CO2==2Na2CO3+O2 的下列说法正确的是 A. CO2是还原剂,在该反应中被氧化 B. Na2O2是氧化剂,在该反应中发生氧化反应 C. 氧化剂和还原剂的物质的量之比为1∶2 D. 若有2 mol Na2O2参加反应,则有2 mol电子转移 |
|
| 9. 选择题 | 详细信息 |
|
Na投入水中发生剧烈反应,并有H2生成.装运金属钠的包装箱应贴的图标是( ) A.  腐蚀品 B. 腐蚀品 B.  爆炸品 爆炸品C.  遇湿易燃品 D. 遇湿易燃品 D.  氧化剂 氧化剂 |
|
| 10. 选择题 | 详细信息 |
|
A.被氧化的元素和被还原的元素的质量之比5:1 B. C.盐酸既体现酸性,又体现还原性 D.氧化剂和还原剂的质量之比为1:6 |
|
| 11. 选择题 | 详细信息 |
|
证明某溶液只含有Fe2+而不含有Fe3+的实验方法最好是 ( ) A. 先滴加氯水,再滴加KSCN溶液后显红色 B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色 C. 滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色 D. 只需滴加KSCN溶液 |
|
| 12. 选择题 | 详细信息 |
|
Fe3+、SO A.Na+ B.OH- C.CO |
|
| 13. 选择题 | 详细信息 |
|
下列化学方程式中,标明电子转移方向和数目均正确的是( ) A. 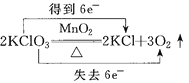 B.  C.  D. |
|
| 14. 选择题 | 详细信息 |
|
不用试剂,只用试管和滴管不能鉴别下列无色溶液的是( ) A.碳酸钠溶液和稀盐酸 B.氯化铝溶液和氢氧化钠溶液 C.偏铝酸钠溶液和稀盐酸 D.氯化钙溶液和碳酸钠溶液 |
|
| 15. 选择题 | 详细信息 |
|
常温下,发生下列反应: ①16H++10Z-+2XO ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-根据上述反应,判断下列结论错误的是( ) A.溶液中可发生:Z2+2A2+=2A3++2Z- B.Z2在①③反应中为还原剂 C.氧化性强弱的顺序为:XO D.X2+是XO |
|
| 16. 选择题 | 详细信息 |
|
有200mL氯化镁和氯化铝的混合溶液,其中 A.40mL B.72mL C.80mL D.128mL |
|
| 17. 选择题 | 详细信息 |
|
下列离子在加入金属钠后的溶液中仍能大量存在的是( ) A.Al3+ B.AlO |
|
| 18. 选择题 | 详细信息 |
|
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( ) A. 9:4 B. 1:1 C. 7:6 D. 6:7 |
|
| 19. 选择题 | 详细信息 |
|
实验室中做焰色反应实验时,每次实验都要洗净铂丝,此试剂是( ) A.硫酸洗涤 B.稀盐酸洗涤 C.水洗涤 D.醋酸洗涤 |
|
| 20. 选择题 | 详细信息 |
|
铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L氢气(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为 A.0.2mol B.0.1mol C.0.05mol D.0.025mol |
|
| 21. 填空题 | 详细信息 |
|
钠和钠的化合物有许多重要的用途,碳酸钠可与氯气发生反应,涉及的反应如下: (1)用双线桥法标出电子转移的方向和数目_______。 (2)该反应的离子方程式为_______。 (3)该反应中氧化剂与还原剂的个数之比是_______ (4)少量的钠应保存在_______中;钠着火时不能用水灭火,原因_______(涉及反应的离子方程式)。 (5)在实验室配制好的NaOH溶液中通入过量的二氧化碳时发生的离子反应是_______。 |
|
| 22. | 详细信息 |
某混合物A含有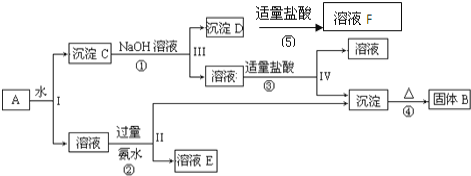 据此回答下列问题: (1)根据上述框图反应关系,写出B、D所含物质的化学式,固体B_______;沉淀D_______;写出①、④两个反应的化学方程式:①_______④_______ (2)写出②、③两个反应的离子方程式: ②_______ ③_______ |
|
| 23. 填空题 | 详细信息 |
|
硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。 (1)可用于制作计算机芯片和太阳能电池的是_______(填化学式,下同),光导纤维的主要成分是_______。 (2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为_______。 (3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:_______。 (4)高纯度单晶硅可以按下列方法制备:SiO2 |
|
| 24. 填空题 | 详细信息 |
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计以下实验。 (1)高温下,让铁粉与水蒸气反应,见题图。试管中发生的化学方程式是_______,该反应中氧化剂是_______。 (2)如下图:  ①往A溶液中滴入几滴KSCN溶液,溶液的颜色_______。 ②写出上述过程中有关反应的化学方程式A→B_______。 ③ ④将A的饱和溶液滴入沸水中并不断加热,可制得_______胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为_______效应。 |
|
最近更新



