2019-2020年高一上册第一次月考化学考试完整版(河南省鲁山县第一高级中学)
| 1. 选择题 | 详细信息 |
|
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( ) A. 发生丁达尔效应 B. 空气中的小水滴颗粒的布朗运动 C. 雾是一种胶体,胶粒带有电荷 D. 空气中的小水滴颗粒直径大小约为1~100 nm |
|
| 2. 选择题 | 详细信息 |
|
我国宋代《梦溪笔谈》中记叙了胆矾和铜的炼制过程:“信州铅山县有苦泉,煮之则得胆矾。熬胆矾铁釜,久之亦化为铜。”该炼制过程中没有涉及到的变化是( ) A. 复分解反应 B. 氧化还原反应 C. 置换反应 D. 蒸发结晶 |
|
| 3. 选择题 | 详细信息 |
|
实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如图。在做实验时,某同学取用硝酸溶液后,应把它放回的位置是( ) A.  D. D.  |
|
| 4. 选择题 | 详细信息 |
|
下列关于氧化物的叙述正确的是( ) A. 金属氧化物不一定是碱性氧化物 B. 与水反应生成碱的氧化物为碱性氧化物 C. 非金属氧化物都是酸性氧化物 D. 不能跟酸反应的氧化物一定能跟碱反应 |
|
| 5. 选择题 | 详细信息 |
|
下列状态的物质,既能导电又属于电解质的是( ) A. 氯化钠固体 B. 硫酸钾溶液 C. 石墨碳棒 D. 熔融氢氧化钾 |
|
| 6. 选择题 | 详细信息 |
|
空气中的自由电子附着在分子或原子上形成的空气负离子(也叫阴离子)被称为“空气维生素”,O22-就是一种空气负离子,其摩尔质量为( ) A. 32g B. 34g C. 32g·mol-1 D. 34g·mol-1 |
|
| 7. 选择题 | 详细信息 |
|
中国药学家屠呦呦因发现青蒿素,开创了治疗疟疾的新方法,荣获了诺贝尔奖。已知青蒿素的分子式为C15H22O5。下列有关说法正确的是( ) A. 青蒿素的摩尔质量为282 g·mol-1 B. 青蒿素中C、H、O的质量之比为15∶22∶5 C. 1 mol青蒿素的体积约为22.4 L D. 1 mol青蒿素中含11 mol H2 |
|
| 8. 选择题 | 详细信息 |
|
若1 g N2中含有x个分子,则阿伏加德罗常数是 A. |
|
| 9. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法中不正确的是( ) A. 1molNH4+所含质子数为10NA B. 20g氖气所含原子数约为6.02×1023 C. 标准状况下,22.4LSO2所含的分子数为NA D. 常温常压下,32gO2和O3的混合气体所含原子数为2NA |
|
| 10. 选择题 | 详细信息 |
下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是: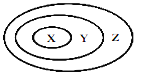 A. 氧化物、化合物、纯净物 B. 碱性氧化物、金属氧化物、氧化物 C. 胶体、分散系、混合物 D. 复分解反应、置换反应、化学反应 |
|
| 11. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
|
||||||||||||||||||||||||||
| 12. 选择题 | 详细信息 |
|
能够用来鉴别氯化钡、氯化钠、碳酸钠三种溶液的试剂是( ) A. 硝酸银溶液 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸 |
|
| 13. 选择题 | 详细信息 |
|
在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,n(K+)=0.1 mol,n(Mg2+)=0.25 mol,n(Cl-)=0.2mol,则n(NO3-)为( ) A. 0.15mol B. 0.20mol C. 0.25mol D. 0.40mol |
|
| 14. 选择题 | 详细信息 |
|
两个相同的容器中,一个盛有CO2气体,另一个盛有H2和Cl2的混合气体,同温同压下,两容器内的气体一定具有相同的( ) A. 原子数 B. 分子数 C. 质量 D. 密度 |
|
| 15. 选择题 | 详细信息 |
|
同温同压下,2体积气体A2和1体积气体B2完全反应生成了2体积气体X,则X的化学式是( ) A. A2B B. A2B2 C. AB2 D. AB3 |
|
| 16. 选择题 | 详细信息 |
一定温度压强下,用相同质量的CH4、CO2、O2、SO2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是 A. 气球B中装的是O2 B. 气球A和气球D中气体物质的量之比为4:1 C. 气球A和气球C中气体分子数相等 D. 气球C和气球D中气体密度之比为2:1 |
|
| 17. 选择题 | 详细信息 |
|
下列除去杂质(括号内的物质为杂质)的方法中错误的是( ) A. 硫酸亚铁溶液(硫酸铜):加足量铁粉后,过滤 B. 一氧化碳(二氧化碳):用氢氧化钠溶液洗气后干燥 C. 二氧化碳(氯化氢):用氢氧化钠溶液洗气后干燥 D. 二氧化锰(氯化钾):加水溶解后,过滤、洗涤、干燥 |
|
| 18. 选择题 | 详细信息 |
|
标准状况下,有①6.72LCH4;②3.01×1023个氯化氢分子;③13.6gH2S;④0.2molNH3。下列对这四种气体的关系,描述不正确的是( ) A. 体积:④<①<②<③ B. 密度:①<④<③<② C. 质量:④<①<③<② D. 氢原子数:②<④<③<① |
|
| 19. 填空题 | 详细信息 |
|
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。 (1)现有下列6种物质:SO2、SiO2、CaO、MgO、Fe2O3、Na2O2。按照不同的分类标准,它们中有一种物质与其他5种有明显的不同,请找出这种物质,并写出依据(写出两种分类方法): ①________。 ②_______。 (2)生活中的食醋和淀粉溶液分别属于分散系中的_____和_____,用_____可以鉴别(填化学专用名词)。 |
|
| 20. 填空题 | 详细信息 |
|
现有下列物质: ①氢氧化钠固体 ②铜丝 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦蔗糖晶体 ⑧熔融氯化钠 请用序号填空: (1)上述状态下可导电的是_______。 (2)属于电解质的是_______。 (3)属于非电解质的是________。 |
|
| 21. 填空题 | 详细信息 |
Ⅰ.甲、乙、丙三种物质有如图所示的转化关系。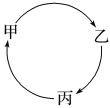 若甲、乙、丙依次是氢气、水、硫酸。 (1)写出甲―→乙的化学方程式:_____。 (2)乙―→丙时所需另一种反应物中,一定含有____和氧元素。 若甲为碳酸钙,丙为氯化钙。 (3)乙可以是______(填名称)。 Ⅱ.N原子的摩尔质量是_____;1molHNO3的质量是____;标准状况下11.2LHCl气体的物质的量是___;2molOH-约含有___个电子。 |
|
| 22. 填空题 | 详细信息 |
|
Ⅰ、同温同压下,若A容器中充满O2、B容器中充满O3。 (1)若所含分子总数相等,则A容器和B容器的容积之比是_____。 (2)若两容器中所含原子总数相等,则A容器和B容器的容积比是____。 Ⅱ、现有14.4g一氧化碳和二氧化碳的混合气体,在标准状况下其体积为8.96L。 请回答下列问题: (1)该混合气体的平均摩尔质量为____。 (2)混合气体中碳原子的个数为____(用NA表示阿伏加德罗常数的值)。 (3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。 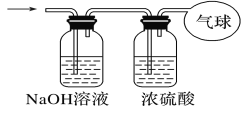 气球中收集到的气体的物质的量为____。 |
|
| 23. 实验题 | 详细信息 |
某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气,并验证气体中是否含有杂质。实验装置图如图: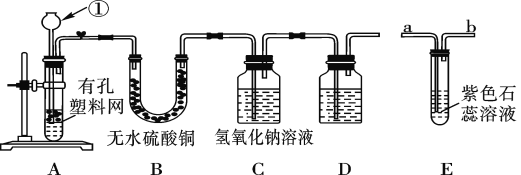 (查阅资料)无水硫酸铜遇水变蓝色。 (1)装置A中仪器①的名称是____;写出发生反应的化学方程式:___。 (2)实验中看到B中无水硫酸铜变蓝色,说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质,可将E装置连接到上述装置____(填序号)之间,气体从____(填“a”或“b”) 进入装置E。 (3)D装置中的试剂是_____(写出名称)。 (4)下列收集氢气的方法中符合题意的是_____。 A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶 |
|
| 24. 计算题 | 详细信息 |
|
实验室常用加热氯酸钾的方法制取少量氧气。 (1)请写出反应的化学方程式。_____ (2)现欲制取1.12L(标准状况)氧气,理论上需要消耗氯酸钾多少克?生成氯化钾物质的量多少?______、______ |
|
最近更新



