2019年湖南省郴州市高三第一次教学质量监测化学考试完整版
| 1. 选择题 | 详细信息 |
|
从古至今化学与生产、生活密切相关。下列说法正确的是 A.常温下,成语“金戈铁马”中的金属能溶于浓硝酸 B.用石灰水或MgSO4溶液喷涂在树干上均可消灭树皮上的过冬虫卵 C.汉代烧制出“明如镜、声如馨”的瓷器,其主要原料为石灰石 D.港珠澳大桥采用的聚乙烯纤维吊绳,其商品名为“力纶”,是有机高分子化合物 |
|
| 2. 选择题 | 详细信息 |
|
化学家创造的酸碱质子理论的要点是:凡能给出质子(H+)的分子或离子都是酸,凡能接受质子(H+)的分子或离子都是碱。按此观点,下列微粒既属于酸又属于碱的是 ①H2O ②CO32- ③Al3+ ④CH3COOH ⑤NH4+⑥H2N-CH2COOH A.②③ B.①⑥ C.④⑥ D.⑤⑥ |
|
| 3. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA C. 生成1mol还原产物时转移电子数为8NA D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA |
|
| 4. 选择题 | 详细信息 |
|
室温下,下列各组微粒在指定溶液中能大量共存的是 A.pH=1的溶液中:CH3CH2OH、Cr2O72-、K+、SO42- B.c(Ca2+)=0.1mol·L-1的溶液中:NH4+、C2O42-、Cl-、Br- C.含大量HCO3-的溶液中:C6H5O-、CO32-、Br-、K+ D.能使甲基橙变为橙色的溶液:Na+、NH4+、CO32-、Cl- |
|
| 5. 选择题 | 详细信息 |
|
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是 A. 砷酸的分子式为H2AsO4 B. 红棕色气体在该原电池的负极区生成并逸出 C. 该反应的氧化剂和还原剂物质的量之比为12:1 D. 该反应中每析出4.8g硫黄,则转移0.5mol电子 |
|
| 6. 选择题 | 详细信息 |
我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下: 下列说法正确的是 A. 图示显示:起始时的2个H2O最终都参与了反应 B. 过程Ⅰ、过程Ⅱ均为放热过程 C. 过程Ⅲ只生成了极性共价键 D. 使用催化剂降低了水煤气变换反应的ΔH |
|
| 7. 选择题 | 详细信息 |
|
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相 等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与 R原子序数之和是W的2倍。下列说法错误的是 A.离子半径:R>T>Y>Z B.XR2、WR2两种化合物中R的化合价相同 C.最高价氧化物对应的水化物的碱性:X>Z D.气态氢化物的稳定性:W<R<T |
|
| 8. 选择题 | 详细信息 |
一种新药物结构如图所示,下列有关该化合物说法正确的是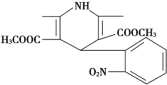 A.分子式为C17H17N2O6 B.能发生水解反应、聚合反应、取代反应、消去反应 C.分子中含有四种不同的官能团 D.能与氢气发生加成反应,但不能与溴的四氯化碳溶液反应 |
|
| 9. 选择题 | 详细信息 |
|
工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯。提取柠檬烯的实验操作步骤如下:柠檬烯 ①将1〜2个橙子皮剪成细碎的碎片,投人乙装置中,加入约30mL水, ②松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧, 打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。下列说法不正确的是 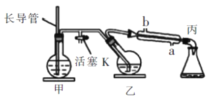 A.当馏出液无明显油珠,澄清透明时,说明蒸馏完成 B.为达到实验目的,应将甲中的长导管换成温度计 C.蒸馏结束后,先把乙中的导气管从溶液中移出,再停止加热 D.要得到纯精油,还需要用到以下分离提纯方法:分馏、蒸馏 |
|
| 10. 选择题 | 详细信息 |
不同条件下,用O2氧化a mol/L FeCl2溶液过程中所 测的实验数据如图所示。下列分析或推测合理的是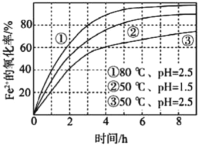 A.由①、②可知,pH越大,+2价铁越易被氧化 B.由②、③推测,若pH>7,+2价铁更难被还原 C.由①、③推测,FeCl2被O2氧化的反应为放热反应 D.60℃、pH=2.5时,4 h内Fe2+的平均消耗速率大于0.15a mol/(L·h) |
|
| 11. 选择题 | 详细信息 |
海水淡化是解决沿海城市饮用水问题的关键技术。下图是电渗析法淡化海水装置的工作原理示意图(电解槽内部的“┆”和“│”表示不同类型的离子交换膜)。工作过程中b电极上持续产生Cl2。下列关于该装置的说法错误的是 A. 工作过程中b极电势高于a极 B. “┆”表示阴离子交换膜,“│”表示阳离子交换膜 C. 海水预处理主要是除去Ca2+、Mg2+等 D. A口流出的是“浓水”,B口流出的是淡水 |
|
| 12. 选择题 | 详细信息 | |||||||||||||||
下列实验操作、现象和所得到的结论均正确的是
|
||||||||||||||||
| 13. 选择题 | 详细信息 |
|
某恒定温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A (g)+2B (g)⇌4C (?)+2D (?),“?”代表状态不确定。反应一段时间后达到平衡,测得生成 1.6 mol C,且反应前后压强之比为5:4,则下列说法正确的是 A.增加C,B的平衡转化率不变 B.此时B的平衡转化率是35% C.增大该体系的压强,平衡向右移动,化学平衡常数增大 D.该反应的化学平衡常数表达式是K= |
|
| 14. 选择题 | 详细信息 |
常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )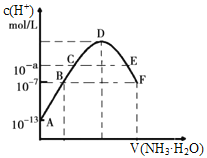 A. NaHB溶液可能为酸性,也可能为碱性 B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大 C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+) D. F点溶液c(NH4+)=2c(B2-) |
|
| 15. | 详细信息 | |||||||||||||||||||||||||||||||||
用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下: 资料:i滤液1、滤液2中部分例子浓度(g·L-1)
|
||||||||||||||||||||||||||||||||||
| 16. 综合题 | 详细信息 |
工业上利用氧化铝基废催化剂(主要成份为Al2O3,少量Pd)回收Al2(SO4)3及Pd 流程如图: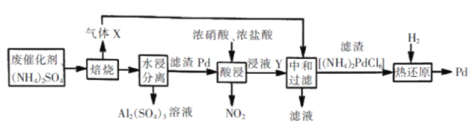 说明:上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。 (1)焙烧时产生气体X的结构式为________。 (2)水浸分离中,滤渣Pd的颗粒比较大,一般可以采用的分离方法是_________ (填字母) A.过滤 B.抽滤 C.倾析 D.渗析 (3)写出酸浸时发生反应的离子方式______(已知氯钯酸为弱酸) (4)某同学在实验室用如下图所示装置完成Pd的热还原实验,并计算滤渣中 (NH4)2PdCl6的百分含量(滤渣中的杂质不参与热还原反应)。 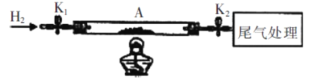 ①写出热还原法过程中发生反应的化学方程式________。 ②i.将石英玻璃管中(带开关;K1和K2)(设为装置A )称重,记为mi g。将滤渣 [(NH4)2PdCl6]装入石英玻璃管中,再次将装置A称重,记为m2 g。 ii.连接好装置后,按d→ → →b→ →e(填标号)顺序进行实验。_______ a.关闭K1和K2 b.熄灭酒精灯 c.点燃酒精灯,加热 d.打开K1和K2 e.称量A f.缓缓通入H2 g.冷却至室温 iii.重复上述操作步骤,直至A恒重,记为m3g。 ③根据实验记录,计算滤渣中(NH4)2PdCl6的百分含量__________[列式表示,其中(NH4)2PdCl6相对分子质量为355]。 ④实验结束时,发现硬质试管右端有少量白色固体,可能是____(填化学式),这种情况导致实验结果_________(填“偏高”、“偏低”、“无影响”) |
|
| 17. 综合题 | 详细信息 | ||||||||
|
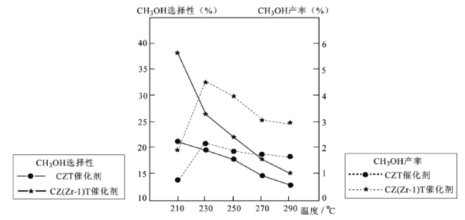
CCuS是一种二氧化碳的捕获、利用与封存的技术,这种技术可将CO2资源化, 产生经济效益。CO2经催化加氢可以生成低碳有机物,主要有以下反应: 反应I:CO2(g)+3H2(g) 反应II:CH3OCH3(g)+H2O(g) 反应III:2CO2(g)+6H2(g) (1)△H3=_____________kJ·mol-1 (2)恒温恒容条件下,在密闭容器中通人等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。 A.容器内的混合气体的密度保持不变B.反应体系总压强保持不变 C.CH3OH和CO2的浓度之比保持不变D.断裂3NA个H-O键同时断裂2NA个C=O键 (3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加人等物质的量的 CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
|
|||||||||
| 18. 综合题 | 详细信息 |
配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。 (1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。 (2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________ ,写出与 CO互为等电子体的分子的电子式:___________________。 (3)C、O、Fe的第一电离能由大到小的顺序为_______________________。 (4)关于Fe(CO)5,下列说法正确的是______。 A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键 C.1 mol Fe(CO)5含有10 mol配位键 D. Fe(CO)5==Fe+5CO反应中没有新化学键生成 (5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。 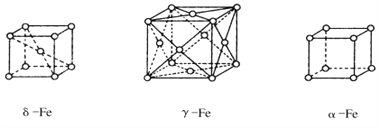 ①上述三种晶体的晶胞中属于面心晶胞的是______ (填“a”“δ””或“γ”)- Fe。 ②a-Fe晶胞中铁原子的配位数为_______________。 ③γ-Fe晶胞的边长为a pm,则γ- Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。 |
|
| 19. 综合题 | 详细信息 |
目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程: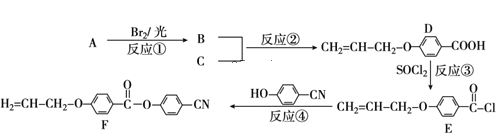 (1)化合物C的结构简式为___。B的官能团名称___。 (2)上述转化过程中属于取代反应的有___(填反应序号)。 (3)写出B与NaOH水溶液反应的化学方程式___。 (4)下列关于化合物D的说法正确的是___(填字母)。 A.属于酯类化合物 B.1molD最多能与4molH2发生加成反应 C.一定条件下发生加聚反应 D.核磁共振氢谱有5组峰 (5)写出符合下列条件下的化合物C的同分异构体的结构简式___(任写一种)。 ①苯环上一溴代物只有2种 ②能发生银镜反应 ③苯环上有3个取代基 (6)请参照上述制备流程,写出以有机物C和乙烯为原料制备  的合成路线流程图(无机试剂任用)___。 的合成路线流程图(无机试剂任用)___。 |
|