重庆南开中学2019年高三化学上册月考测验在线做题
| 1. 选择题 | 详细信息 |
|
化学与社会、生产、生活密切相关,下列说法正确的是 A. 鲜花运输途中需喷洒高锰酸钾稀溶液,主要是为鲜花补充钾肥 B. 牙膏中添加的SrF2、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相同 C. 自来水厂用明矾净水,用Fe2(SO4)3或ClO2均能代替明矾净水 D. 变质的植物油有难闻的特殊气味,是由于植物油发生了加成反应 |
|
| 2. 选择题 | 详细信息 | |||||||||||||||
下列实验及检验方法合理的是
|
||||||||||||||||
| 3. 选择题 | 详细信息 |
|
用NA代表阿伏伽德罗常数的值。下列叙述正确的是 A. 用铅蓄电池电解氯化钠溶液得到标准状况下22.4L氢气时理论上铅蓄电池中消耗氢离子数目为4NA B. 1L0.1mol·L-1NH4Cl溶液中含有的氮原子数小于0.1NA C. 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA D. 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
|
| 4. 选择题 | 详细信息 |
|
能使溴水褪色,含有3个甲基,其分子式为C6H11Br的有机物(不考虑立体异构)共有( ) A. 10种 B. 11种 C. 12种 D. 13种 |
|
| 5. 选择题 | 详细信息 |
|
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同。25℃时,0.1mol/LX和W形成化合物的水溶液pH=1。下列说法正确的是 A. Z与Y、Z与W形成的化合物的化学键完全相同 B. Y、Z、W三种元素组成的化合物的水溶液可能显碱性 C. 简单离子的半径:Z﹥R﹥W﹥Y D. 因非金属Y﹥R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
|
| 6. 选择题 | 详细信息 |
下列图示与对应的叙述相符的是( ) A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化 B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) |
|
| 7. 选择题 | 详细信息 |
在100mL K2CO3与KAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,如图所示。下列说法正确的是 A. a点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-) B. b点所得溶液中阴离子浓度大小顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-) C. c点溶液中:c(Cl-)+c(HCO3-)+c(H2CO3)+c(CO32-)=1.5 mol·L-1 D. d→e的过程中水的电离程度逐渐减小 |
|
| 8. | 详细信息 |
现有一种制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下: 注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl﹣=2[CuCl2]﹣+S 请回答下列问题: (1)传统工艺制铜是将铜矿砂与空气在高温下煅烧,使这种方法的缺点是要消耗大量的热能以及____________________________(完成合理的一种即可)。 (2)为使反应Ⅰ中充分进行,工业可采取的措施是_________(完成合理的一种即可),反应Ⅰ的产物为(填化学式) ___________________。 (3)反应Ⅲ的离子方程式为______________________________________,一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是____________________________。 (4)工业上炼钢时,为了降低含碳量,可将铁红投入熔融的生铁(含碳量大于2%的铁碳合金)中,该过程中主要反应的化学方程式是___________________________________。 (5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取560mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol•L﹣1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液50.00mL。 已知Cr2O72﹣+Fe2++H+→Cr3++Fe3++H2O(未配平) ①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________ 。 ②反应Ⅳ所得气体中SO2的体积分数为_________________ 。 |
|
| 9. 综合题 | 详细信息 |
|
研究氮及其化合物对化工生产有重要意义。 (1)已知:N2(g)+O2(g)=2NO(g); △H=+180 kJ·mol-1 4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908 kJ·mol-1 请写出氨气被一氧化氮氧化生成无毒气体的热化学方程式:___________。 (2)工业合成氨的原理为:N2(g)+3H2(g)  ①已知图甲中0~t1 min内,v(H2)=0.03 mol·L-1·min-1,则t1=________ min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是____________________________(填一种即可)。 ②图乙中,b点时k=_________。 ③已知某温度下该反应的平衡常数K=10,在该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1 mol/L,c(N2)=0.5 mol/L,c(NH3)=0.1 mol/L,则在平衡建立过程中NH3的浓度变化趋势是__________(填“逐渐增大”“逐渐减小”或“恒定不变”)。 (3)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似,是一种应用广泛的化工原料,可用作火箭燃料。(已知:N2H4+H+ ①N2H5+的电子式为_______。联氨与硫酸形成的酸式盐的化学式为________。 ②联氨是一种常用的还原剂。向装有少量AgCl的试管中加入联氨溶液,观察到的现象___________________________________________________________。 (4)尿素(CO(NH2)2)是目前使用量较大的一种化学氮肥,工业上利用下图所示装置(阴、阳极均为惰性电极)电解尿素的碱性溶液制取氢气。  ①该装置中阳极的总电极反应式为_____________________________________________。 ②若两极共收集到气体22.4L(标准状况),则消耗的尿素为____________g(忽略气体的溶解)。 |
|
| 10. 实验题 | 详细信息 | ||||||||||||||||
|
以NaCl为主要成分的融雪剂会腐蚀桥梁、铁轨等钢铁设备。某研究小组探究NaCl溶液对钢铁腐蚀的影响。 (1)将滤纸用3.5%的NaCl溶液润湿,涂上铁粉、碳粉的混合物,贴在表面皿上。在滤纸上加几滴检验试剂,再缓慢加入NaCl溶液至没过滤纸,操作如下所示:  ①实验ⅰ的现象说明,得电子的物质是_______________________________。 ②碳粉的作用是___________________________________________________。 ③为了说明NaCl的作用,需要补充的对照实验是_____________________。 (2)向如图示装置的烧杯a、b中各加入30mL 3.5%的NaCl溶液,闭合K,指针未发生偏转。加热烧杯a,指针向右偏转。 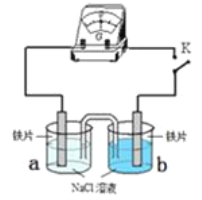 ①取a、b中溶液少量,滴加K3[Fe(CN)6]溶液,a中出现蓝色沉淀,b中无变化,b中铁片作________极。 ②加热后,指针发生偏转的原因可能是_____________________。 (3)用(2)中图示装置探究不同浓度NaCl溶液对钢铁腐蚀的影响,向烧杯a、b中各加入30mL不同质量分数的NaCl溶液,实验记录如下表所示。
|
|||||||||||||||||
| 11. 综合题 | 详细信息 |
|
铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题: (1)铁、钴、镍的基态原子核外未成对电子数最多的是_________。 (2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为_______(用相应的元素符号表示);氮原子的杂化轨道类型为________。  (3)Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_______(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=________。 (4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO______FeO(填“>”“<”或“=”),原因是_________。 (5)NiAs的晶胞结构如图所示:①镍离子的配位数为_________。 ②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为________cm。(写出计算表达式) |
|
| 12. 综合题 | 详细信息 |
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。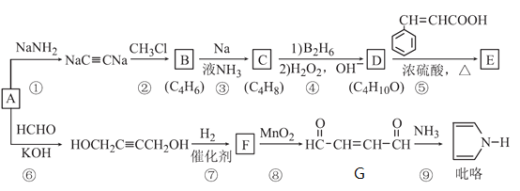 回答下列问题: (1)A的官能团名称是_______________;C的名称是_______________; (2)⑥的反应类型是_______________。⑧的反应类型是_______________。 (3)反应⑤的化学方程式为____________________________。 (4)满足下列条件的肉桂酸( (6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯( |
|
高中化学 试卷推荐
最近更新



