咸阳市2019年高二前半期化学期中考试网上考试练习
| 1. 选择题 | 详细信息 |
|
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( ) A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,故不必加热就可发生反应 |
|
| 2. 选择题 | 详细信息 |
|
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为( ) A.A+3B=2C B.2A+3B=2C C.3A+B=2C D.A+B=C |
|
| 3. 选择题 | 详细信息 |
|
下列物质中属于非电解质,但放入水中所得溶液可导电的是 ( ) A.C2H5OH B.Cu C.H2SO4 D.CO2 |
|
| 4. 选择题 | 详细信息 |
|
对于可逆反应:2SO2(g)+O2(g) A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2 |
|
| 5. 选择题 | 详细信息 |
|
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa): ①C4H10(g)+ ②C4H10(g)+ ③C4H10(g)+ ④C4H10(g)+ 由此判断,正丁烷的燃烧热是 ( ) A.ΔH=-1 746kJ·mol-1 B.ΔH=-2 658 kJ·mol-1 C.ΔH=-2 878 kJ·mol-1 D.ΔH=-1 526 kJ·mol-1 |
|
| 6. 选择题 | 详细信息 |
|
酸碱滴定实验时,必须要按以下要求操作的是( ) A.锥形瓶用蒸馏水洗净后要烘干 B.酸式或碱式滴定管用水洗净后用相应溶液润洗 C.待测液一定要放在锥形瓶中 D.滴定前读数时,凹液面最低处必须与“0”刻度线齐平 |
|
| 7. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A.同一物质的固、液、气三种状态的熵值相同 B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ;ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 C.焓变或熵变均可以单独作为反应自发性的判据 D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
|
| 8. 选择题 | 详细信息 |
|
已知红磷通常要比白磷稳定,下列两个反应: ①P4(白磷,s)+5O2(g)=2P2O5(s) △H1 ②4P(红磷,s)+5O2(g)=2P2O5(s) △H2 则△H1和△H2的关系是 A.△H1=△H2 B.△H1>△H2 C.△H1<△H2 D.无法确定 |
|
| 9. 选择题 | 详细信息 |
|
足量的Zn与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但又不影响生成氢气的总量,可向盐酸中加入适量的物质是 ( ) A.NaOH固体 B.CH3COONa固体 C.NaCl晶体 D .Na2CO3固体 |
|
| 10. 选择题 | 详细信息 |
燃煤脱硫可减少SO2的排放,燃煤脱硫技术受到各界科研人员的关注。某种燃煤脱硫技术的原理为CaO(s)+3CO(g)+SO2(g) ⇌CaS(s)+3CO2(g) ΔH=-394.0 kJ·mol-1。保持其他条件不变,平衡时CO2的体积分数随起始CO物质的量的变化关系如图所示: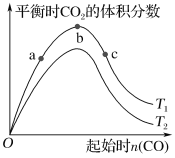 下列有关说法正确的是( ) A.T1>T2 B.T1时,b点对应状态的SO2转化率最高 C.T1时,b点后曲线下降是因为CO质量分数升高 D.减小压强可提高CO、SO2转化率 |
|
| 11. 选择题 | 详细信息 |
|
在中和滴定中,下列操作或说法不正确的是( ) A.使用滴定管时,滴定管必须用待装液润洗2~3次 B.酸式滴定管不能装碱液,碱式滴定管不能装酸液或强氧化性溶液 C.装待测液的锥形瓶应预先用待测液润洗 D.滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整 |
|
| 12. 选择题 | 详细信息 |
|
一定条件下反应2AB(g)⇌ A2(g) + B2(g)达到平衡状态的标志是 ( ) A.2υ正(AB)= υ逆(A2) B.容器内三种气体AB、A2、B2共存 C.单位时间内消耗n mol A2,同时消耗n mol AB D.容器中各组分的体积分数不随时间变化 |
|
| 13. 选择题 | 详细信息 |
|
在0.1 mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+ ,对于该平衡,下列叙述正确的是 ( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1 mol·L-1HCl溶液,溶液中c(H+)不变 D.加入少量CH3COONa固体,平衡向正反应方向移动 |
|
| 14. 选择题 | 详细信息 |
|
下列可逆反应达到平衡后,加压和升高温度均可使平衡向逆反应方向移动的是 ( ) A.4NH3(g)+5O2(g) ⇌4NO(g)+6H2O(g) ΔH<0 B.A2(g)+B2(g) ⇌2AB(g) ΔH<0 C.W(g) ⇌Z(g) ΔH<0 D.2SO3(g) ⇌2SO2(g)+O2(g) ΔH>0 |
|
| 15. 选择题 | 详细信息 |
|
下列图象能正确地表达可逆反应3A(g)+B(g) ⇌2C(g)(ΔH<0)的是 ( ) A. 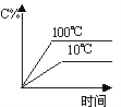 B. B. C. 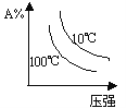 D. D.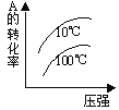 |
|
| 16. 填空题 | 详细信息 |
|
按要求写出下列物质的电离方程式(分步电离只写第一步): (1)NH3溶于水 ______________________________________________; (2)KHSO4溶于水______________________________________________; (3)NaHCO3溶于水______________________________________________; (4)Al2(SO4)3溶于水_____________________________________________; (5)H2CO3溶于水 ________________________________________________; (6)熔融状态下KHSO4____________________________________________; (7)BaSO4溶于水________________________________________________; (8)HClO的电离 ________________________________________________; |
|
| 17. 综合题 | 详细信息 |
|
(I)常温下,回答下列问题:(提示:lg2 = 0.3) (1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________; (2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________; (3)将pH=11的氨水稀释100倍后pH范围为___________________________________; (4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________; (5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。 (II)反应A(s)+2B(g)⇌2C(g)在密闭容器中达到平衡。 (1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。 (2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。 (3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。 (4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。 |
|
| 18. 综合题 | 详细信息 |
在不同温度下的水溶液中,c(H+)和c(OH-)的关系如图所示: (1)A点水的离子积为_____________,C点水的离子积为_____________,对纯水由25℃升高温度至100℃时水的离子积__________(填“增大”、“减小”或“不变”),各离子浓度由______点(填A、B、C、D)变为______点(填A、B、C、D)。 (2)100 ℃时,若向B点溶液中滴加硫酸,体系将由B点移向_____点(填C或D),为什么_____________________________________。 (3)25 ℃时,0.001mol/L的盐酸溶液pH=_______;0.001mol/L的氢氧化钠溶液pH=_________;若将二者温度都升高至100 ℃,________________(填“盐酸”、“氢氧化钠”或“盐酸和氢氧化钠”)的 pH会改变。 |
|
| 19. 综合题 | 详细信息 |
|
(I)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)⇌2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:  (1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式) (2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。 (3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。 A.接触室中气体的平均相对分子质量不再改变 B.接触室中SO2、O2、SO3的浓度相同 C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2 D.接触室中压强不随时间变化而变化 (II)已知工业制氢气的反应为CO(g)+H2O(g) ⇌CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。  (4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。 (5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。 (6)已知2H2(g)+O2(g) ⇌2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。 |
|
| 20. 实验题 | 详细信息 | ||||||||||||||||||
|
某同学用已知浓度的盐酸来测定某氢氧化钠样品的纯度(杂志不参与反应),试根据实验回答下列问题: (1)准确称量5.0 g含有少量易溶杂质的样品,配成1L待测溶液。称量时,样品可放在________(填字母)称量。 A.小烧杯中 B.洁净纸片上 C.托盘上 (2)滴定时,用0.100 0 mol·L-1的盐酸来滴定待测溶液,可选用________作指示剂。 A.甲基橙 B.石蕊 C.酚酞 (3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在_______(填“甲”或“乙”)中。该同学选用酚酞做指示剂,如何判断达到滴定终点:_______________________________。  (4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______________ mol·L-1,烧碱样品的纯度是_______________。
|
|||||||||||||||||||
最近更新



