高一前半期期末考试化学题带答案和解析(2019-2020年安徽省宣城市)
| 1. 选择题 | 详细信息 | |||||||||||||||
垃圾分类可以减少污染、节约资源。下列“垃圾”放置位置不合理的是
|
||||||||||||||||
| 2. 选择题 | 详细信息 |
|
我国的瓷器以“入窑一色,出窑万彩"的神奇窑变而着称。下列关于陶瓷的说法正确的是 A.瓷器中含有许多金属元素,因此陶瓷属于金属材料 B.高品质的白瓷晶莹剔透,属于纯净物 C.氮化硅陶瓷属于传统无机非金属材料 D.“窑变”是高温下釉料中某些金属化合物发生氧化还原反应导致的颜色变化 |
|
| 3. 选择题 | 详细信息 |
|
下列关于“摩尔质量”的描述或应用,正确的是 A.二氧化碳的摩尔质量等于它的相对分子质量 B.一个氟原子的质量约等于 C.空气的摩尔质量为29 D.1 mol Cl-的质量为35.5 |
|
| 4. 选择题 | 详细信息 | ||||||||||||
很多化学反应在4K高清摄影机下美轮美奂。下列反应不属于氧化还原反应的是
|
|||||||||||||
| 5. 选择题 | 详细信息 |
|
下列物质在水溶液中的电离方程式书写正确的是 A.NaHCO3=Na++ C.MgSO4= Mg+2+ |
|
| 6. 选择题 | 详细信息 | |||||||||||||||
下列物质的分类正确的是
|
||||||||||||||||
| 7. 选择题 | 详细信息 |
以下是四位同学在学习了《化学必修一》后,对一些知识的认识,你认为正确的是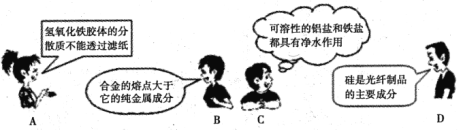 A.A B.B C.C D.D |
|
| 8. 选择题 | 详细信息 |
相同状况下,体积相等的五个气球分别充满相应的气体,如下图所示。与氯化氢气球中所含原子数一定相等的是 A.A B.B C.C D.D |
|
| 9. 选择题 | 详细信息 |
|
有些物质既能与强酸溶液反应又能与强碱溶液反应,下列物质不具有此类性质的是 A.四氧化三铁 B.碳酸氢钠 C.铝 D.氢氧化铝 |
|
| 10. 选择题 | 详细信息 |
|
下列物质间的转化不能通过一步反应实现的是 A.Na2CO3→NaOH B.Fe→FeCl2 C.Fe(OH)2→Fe(OH)3 D.SiO2→H2SiO3 |
|
| 11. 选择题 | 详细信息 |
|
可以根据5I- + A.I2是氧化产物,H2O是还原产物 B. C.该条件下氧化性: |
|
| 12. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是 A.标准状况下,22.4 L H2O含有的分子数为NA B.常温常压下,1.06 g Na2CO3溶于水,溶液中Na+数目为0.02NA C.NA个O2分子占有的体积约为22.4 L D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含Cl-数目为NA |
|
| 13. 选择题 | 详细信息 |
|
下列离子组能大量共存且溶液为无色透明的是 A.K+、 C.H+、Na+、Cl-、 |
|
| 14. 选择题 | 详细信息 |
|
下列反应的离子方程式书写不正确的是 A.金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ B.氯气与水反应:Cl2+H2O=H++Cl-+HClO C.稀盐酸与碳酸钙反应:CaCO3+2H+=Ca2+ +CO2↑+H2O D.稀硫酸与铁反应:6H++2Fe=2Fe3++3H2↑ |
|
| 15. 选择题 | 详细信息 | ||||||||
下列实验装置及操作不能达到实验目的的是
|
|||||||||
| 16. 选择题 | 详细信息 | |||||||||||||||
下列“解释或结论” 正确的是
|
||||||||||||||||
| 17. 选择题 | 详细信息 |
|
下列溶液分别加水稀释到100 mL,稀释后的溶液中氯离子浓度最大的是 ( ) A.20mL 1mol·L−1的AlCl3 B.50mL 1mol·L−1的KCl C.20mL 2mol·L−1的NH4Cl D.20mL 2mol·L−1的CaCl2 |
|
| 18. 选择题 | 详细信息 |
溶液的导电能力可以用电导率表示。向滴有酚酞的100 mL 0.01 mol/LBa(OH)2溶液中,逐滴滴入0.04 mol /LH2SO4溶液实验测得溶液的电导率变化如下图所示。关于该反应的说法不正确的是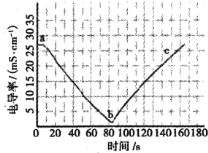 A.0-85s观察到的现象:溶液中有白色沉淀生成,溶液红色逐渐变浅,最后变为无色 B.a→b过程中发生的离子反应为:H++ C.滴至b点时消耗H2SO4溶液25 mL D.b→c过程溶液的电导率变大是由于溶液中H+和 |
|
| 19. 填空题 | 详细信息 |
下图是地壳中含量较大的九种元素分布图,图中X、Y、Z分别表示不同元素。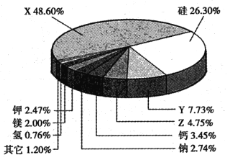 回答下列问题: (1)X的名称为________,硅元素在自然界以______ (填"游离态"或“化合态”)形式存在。 (2)Y的氧化物属于______氧化物, 硅的氧化物属于______氧化物(填“酸性”、 “两性”或“碱性" )。 (3)常用ZCl3溶液作为刻制印刷电路时的“腐蚀液" ,该反应的离子方程式为__________,区别ZCl3溶液和Z(OH)3胶体的方法是__________。 (4)由粗硅制备硅烷(SiH4)的基本流程如下图所示(反应条件均省略):  已知:反应I、II的化学方程式分别为Si+3HC1=SiHCl3+A,SiHCl3+B=Si+3HC1( 均已配平)。 ①A的化学式为_______。 ②反应I、II、III中,有_______个属于氧化还原反应。 ③反应IV中生成的SiH4和NH3两种气体的物质的量之比为_______。 |
|
| 20. 实验题 | 详细信息 |
实验室用下图的实验装置模拟工业制漂白粉。回答下列问题: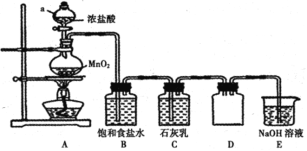 (1)仪器a的名称是_________。 (2)写出A装置中反应的化学方程式并标出电子转移的方向和数目__________。 (3)浓盐酸在反应中的作用是________,饱和食盐水的作用是_______,D装置的作用是_________。 (4)C装置制取漂白粉的化学方程式是__________。 |
|
| 21. | 详细信息 |
某同学用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3。不考虑其它杂质)制取绿矾(FeSO4· 7H2O),设计了如下流程(部分物质巳略去)。 回答下列问题: (1)硫铁矿的主要成分是FeS2,其中铁元素化合价为_______,焙烧产物之一的Fe2O3,俗称________。 (2)固体A的主要成分是_______,固体X为_________。 (3)写出①中Al2O3发生反应的离子方程式:__________。 (4)从溶液C到绿矾的过程中,须控制反应条件防止变质,检验其变质所用的化学试剂是________,步骤③所得Al(OH)3沉淀含有杂质,应如何洗涤?__________。 |
|
| 22. 实验题 | 详细信息 |
某兴趣小组在处理污水样品吋,需将质量分数为37%的浓盐酸(密度为1.19g /cm3)配制成250 mL 0.3mol/L的盐酸。回答下列问题: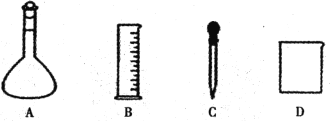 (1)配制此溶液除上图仪器外,还需要的仪器是_______,按使用的先后顺序,其作用分别是____和_______。 (2)A、B仪器的规格分别是______、________(填代号)。 ①10 mL ②100 mL ③250 mL ④500 mL (3)下列说法正确的是______ ( 填代号)。 A.使用的容量瓶必须洁净,但不一定需要干燥 B.配制溶液肘,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1 – 2 cm处,改用胶头滴管加蒸馏水至刻度线 C.实验所用的量筒、烧杯等都要洗涤2~3次,洗涤液要全部注入容量瓶 D.若定容时俯视液面,所配溶液的物质的量浓度偏高 (4)求质量分数为37%的浓盐酸的物质的量浓度_______(要求写出计算辻程,计算结果保留两位小数)。 |
|
最近更新