四川省绵阳市南山中学2020-2021年高一上半期12月月考化学免费试卷完整版
| 1. 选择题 | 详细信息 |
|
化学与科技、社会、生产密切相关,下列说法错误的是 A.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,所用的分离操作方法是蒸馏 B.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土 C.“玉兔二号”月球车首次实现在月球背面着陆,其帆板太阳能电池的材料是硅 D.我国出土的青铜礼器司母戊鼎是铜和铁的合金 |
|
| 2. 选择题 | 详细信息 |
|
下列物品的主要成分不为SiO2的是 A.石英坩埚 B.玛瑙饰物 C.砖瓦 D.水晶花瓶 |
|
| 3. 选择题 | 详细信息 |
|
日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是 A.钢铁生锈 B.充有H2的“喜羊羊”娃娃遇明火发生爆炸 C.食物腐败变质 D.石灰石分解 |
|
| 4. 选择题 | 详细信息 |
|
下列叙述正确的是 ( ) A. 氯化钠溶液在电流作用下电离成钠离子和氯离子 B. 溶于水后能电离出氢离子的化合物一定是酸 C. 硫酸钡难溶于水,但硫酸钡属于电解质 D. 三氧化硫溶于水,生成的硫酸能导电,故三氧化硫属于电解质 |
|
| 5. 选择题 | 详细信息 | ||||||||||||
下列实验仪器或装置的选择正确的是
A.A B.B C.C D.D |
|||||||||||||
| 6. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是 A.1.8g的NH B.标准状况下,22.4 L CCl4含NA个分子 C.通入1 mol Cl2的新制氯水中,HClO、Cl-、C1O-粒子数之和为2NA D.足量MnO2和80mL 10 mol/L浓盐酸共热可生成0.2NA个Cl2分子 |
|
| 7. 选择题 | 详细信息 |
|
将下列溶液分别稀释到100 mL,稀释后的溶液中氯离子浓度最大的是 A. 15 mL 1 mol•L﹣1的AlCl3 B. 50 mL 1 mol•L﹣1的KCl C. 20 mL 2 mol•L﹣1的NH4Cl D. 10 mL 2 mol•L﹣1的CaCl2 |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列物质中的杂质(括号内为杂质),所选用试剂及操作方法不正确的是
A.A B.B C.C D.D |
|||||||||||||||||||||
| 9. 选择题 | 详细信息 |
|
已知有如下反应: ①2 ③2FeCl3+2KI=2FeCl2+2KCl+I2 ④2FeCl2+Cl2=2FeCl3 下列叙述正确的是 A.①反应氧化剂和还原剂的物质的量之比为1:2 B.还原能力Fe2+>I->Cl- C.氧化能力: D.反应 |
|
| 10. 选择题 | 详细信息 |
|
下列说法正确的是 A.Na2O和Na2O2都能与水反应生成碱,所以它们都是碱性氧化物 B.制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸 C.配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g胆矾晶体 D.向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变 |
|
| 11. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A.氢氧化铁与盐酸反应:H++OH-=H2O B.FeSO4酸性溶液中加H2O2溶液:Fe2++H2O2+2H+=Fe3++2H2O C.硅酸钠与盐酸反应的离子方程式:Na2SiO3+2H+ =H2SiO3↓+2Na+ D.过量NaHSO4溶液与少量Ba(OH)2反应:2H++ |
|
| 12. 选择题 | 详细信息 |
|
下列各组离子在指定溶液中一定能大量共存的是 A.0.1 mol·L−1 NaHSO4溶液中: B.含大量Fe3+的溶液中:K+、 C.pH=12的无色溶液中:Na+、Al3+、MnO D.能溶解氧化铝的溶液中:K+、Ca2+、Cl-、 |
|
| 13. 选择题 | 详细信息 |
|
酸性KMnO4溶液和CuS混合时,发生反应: A.被氧化的元素是Cu和S B. C.氧化剂与还原剂的物质的量之比为6:5 D.若生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol |
|
| 14. 选择题 | 详细信息 |
从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下: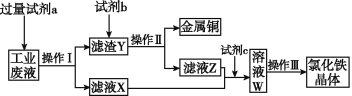 则下列说法正确的是 A. 试剂a是铁,试剂b是稀硫酸 B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同 C. 试剂c是氯气,反应的离子方程式为2Fe2++Cl2 D. 用KSCN溶液可检验溶液W中是否有Fe2+ |
|
| 15. 填空题 | 详细信息 |
|
现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氯水;⑨空气;⑩硫酸亚铁溶液。 (1)属于电解质的是___________,上述状态下能导电的是_____________。 (2)除去③中少量②的操作是____________,化学方程式为____________。 (3)向⑧中滴入几滴石蕊溶液,现象是___________,说明⑧具有_________性。 (4)向⑩中加入⑥的水溶液,产生的现象是_______________。 |
|
| 16. 填空题 | 详细信息 |
|
(1)已知:用毛笔蘸取少量30%的FeCl3溶液在铜片上写一个“Cu”,放置片刻后用少量蒸馏水冲洗铜片后,在铜片上会出现凹凸的“Cu”,写出该反应的离子方程式:___________。 (2)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,其反应可表示为:Fe(OH)3+ClO-+OH-= (3)某同学在做Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的一次实验中,用过量的稀硝酸(其密度为1.05 g/mL,HNO3的质量分数为12%)跟一定量的铁片反应,产生了标准状况下0.56 L的一氧化氮,该稀硝酸的物质的量浓度为___________,被还原的HNO3的物质的量为___________,转移电子的数目为___________。 |
|
| 17. 填空题 | 详细信息 |
|
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。 (1)配制 (2)将已配制好的溶液滴入沸水中并煮沸,可得到红褐色液体,该反应的离子方程式为_______,下列关于该液体的说法正确的是_______________。 a.光束通过该液体时形成光亮的“通路” b.向该液体中加入 c.该液体能发生电泳现象,阴极附近颜色变深 d.将该液体加热、蒸干、灼烧后,有氧化物生成 (3)某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题: 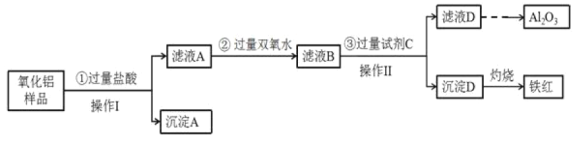 ①操作I的名称是_________,该操作用到的玻璃棒的作用:_________________________。 ②沉淀A的成分是__________(填化学式);验证滤液A中存在 ③滤液D焰色反应呈黄色,试剂C是_______________(填化学式);步骤③中铝元素转化的离子方程式为_______________。 |
|
| 18. 实验题 | 详细信息 |
在实验室中用二氧化锰与浓盐酸在加热条件下反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示: (1)连接上述仪器的正确顺序(填各接口处的字母):E接________;________接________;________接________;________接F。 (2)写出下列反应的化学方程式: ①气体发生装置中进行的反应:__________。 ②NaOH溶液中发生的反应:_______________。 (3)装置中,饱和食盐水的作用是 __________________;浓硫酸的作用是_______________。 (4)化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应化学方程式为______________。 (5)工业上氯气和石灰乳反应可以制取漂白粉,家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是(______) A 食盐 B 食醋 C 烧碱 D 纯碱 该反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生杂质Ca(ClO3)2,该副反应中还原剂与氧化剂的质量之比为________; |
|
| 19. 计算题 | 详细信息 |
|
铁和氧化铁的混合物15 g中加入150 mL稀H2SO4放出氢气1.68 L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH溶液200 mL。求: (1)稀H2SO4的物质的量浓度为_________。 (2)混合物中铁的质量分数________。(保留2位小数,写出具体计算过程) |
|
最近更新