2019е№ҙ6жңҲй«ҳдәҢйҳ¶ж®өжҖ§иҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲжөҷжұҹзңҒдёҪж°ҙеӣӣж ЎиҒ”иҖғпјү
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ25в„ғгҖҒ101 kPaдёӢпјҢ1 gз”ІйҶҮзҮғзғ§з”ҹжҲҗCO2е’Ңж¶ІжҖҒж°ҙж—¶ж”ҫзғӯ22.68 kJ,дёӢеҲ—зғӯеҢ–еӯҰж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜпјҲ пјү A. CH3OHпјҲlпјү+ B. 2CH3OHпјҲlпјү+3O2пјҲgпјү===2CO2пјҲgпјү+4H2OпјҲlпјүпјӣО”H= пјҚ1452 kJ/mol C. 2CH3OHпјҲlпјү+3O2пјҲgпјү===2CO2пјҲgпјү+4H2OпјҲlпјүпјӣО”H= пјҚ725.8 kJ/mol D. 2CH3OHпјҲlпјү+3O2пјҲgпјү===2CO2пјҲgпјү+4H2OпјҲlпјүпјӣО”H=" +1452" kJ/mol |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зғӯеҢ–еӯҰж–№зЁӢејҸдёӯпјҢеҢ–еӯҰеҸҚеә”зҡ„О”HеүҚиҖ…еӨ§дәҺеҗҺиҖ…зҡ„жҳҜ (гҖҖгҖҖ) в‘ C(s)пјӢO2(g)===CO2(g)гҖҖО”H1 C(s)пјӢO2(g)===CO(g)гҖҖО”H2 в‘ЎS(s)пјӢO2(g)===SO2(g)гҖҖО”H3 S(g)пјӢO2(g)===SO2(g)гҖҖО”H4 в‘ўH2(g)пјӢO2(g)===H2O(l) О”H5 2H2(g)пјӢO2(g)===2H2O(l)гҖҖО”H6 в‘ЈCaCO3(s)===CaO(s)пјӢCO2(g)гҖҖО”H7 CaO(s)пјӢH2O(l)===Ca(OH)2(s)гҖҖО”H8 A. в‘ B. в‘Ј C. в‘Ўв‘ўв‘Ј D. в‘ в‘Ўв‘ў |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҰӮеҸіеӣҫжүҖзӨәпјҢе°Ҷй“ҒжЈ’е’ҢзҹіеўЁжЈ’жҸ’е…ҘзӣӣжңүйҘұе’ҢNaClжә¶ж¶Ізҡ„UеһӢз®ЎдёӯгҖӮдёӢеҲ—еҲҶжһҗжӯЈзЎ®зҡ„пјҲпјү A. K1й—ӯеҗҲпјҢй“ҒжЈ’дёҠеҸ‘з”ҹзҡ„еҸҚеә”дёә2HпјӢпјӢ2eпјҚ=H2вҶ‘ B. K1й—ӯеҗҲпјҢзҹіеўЁжЈ’е‘Ёеӣҙжә¶ж¶ІзўұжҖ§еўһејә C. K2й—ӯеҗҲпјҢй“ҒжЈ’дёҚдјҡиў«и…җиҡҖпјҢеұһдәҺзүәзүІйҳіжһҒзҡ„йҳҙжһҒдҝқжҠӨжі• D. K2й—ӯеҗҲпјҢз”өи·ҜдёӯйҖҡиҝҮ0.002NAдёӘз”өеӯҗж—¶пјҢдёӨжһҒе…ұдә§з”ҹ0.001molж°”дҪ“ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зӣёеҗҢжқҗиҙЁзҡ„й“ҒеңЁдёӢеҲ—жғ…еҪўдёӢжңҖдёҚжҳ“иў«и…җиҡҖзҡ„жҳҜ A.  B. B.  C.  D. D.  |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡв‘ 1 mol H2еҲҶеӯҗдёӯеҢ–еӯҰй”®ж–ӯиЈӮж—¶йңҖиҰҒеҗёж”¶436kJзҡ„иғҪйҮҸ в‘Ў1 mol Cl2еҲҶеӯҗдёӯеҢ–еӯҰй”®ж–ӯиЈӮж—¶йңҖиҰҒеҗёж”¶243kJзҡ„иғҪйҮҸ в‘ўз”ұHеҺҹеӯҗе’ҢClеҺҹеӯҗеҪўжҲҗ1 mol HClеҲҶеӯҗж—¶йҮҠж”ҫ431kJзҡ„иғҪйҮҸ дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. ж°ўж°”е’Ңж°Ҝж°”еҸҚеә”з”ҹжҲҗж°ҜеҢ–ж°ўж°”дҪ“зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜH2(g)пјӢCl2(g)пјқ2HCl(g) B. ж°ўж°”е’Ңж°Ҝж°”еҸҚеә”з”ҹжҲҗ2 molж°ҜеҢ–ж°ўж°”дҪ“пјҢеҸҚеә”зҡ„в–іHпјқ183kJ/mol C. ж°ўж°”е’Ңж°Ҝж°”еҸҚеә”з”ҹжҲҗ2 molж°ҜеҢ–ж°ўж°”дҪ“пјҢеҸҚеә”зҡ„в–іHпјқпјҚ183kJ/mol D. ж°ўж°”е’Ңж°Ҝж°”еҸҚеә”з”ҹжҲҗ1 molж°ҜеҢ–ж°ўж°”дҪ“пјҢеҸҚеә”зҡ„в–іHпјқпјҚ183kJ/mol |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёжғ°жҖ§з”өжһҒз”өи§Ј2LгҖҒ1mol/Lзҡ„CuSO4жә¶ж¶ІпјҢеңЁз”өи·ҜдёӯйҖҡиҝҮ0.5molз”өеӯҗеҗҺпјҢи°ғжҚўжӯЈгҖҒиҙҹжһҒ,з”өи·ҜдёӯеҸҲйҖҡиҝҮдәҶ1molз”өеӯҗпјҢжӯӨж—¶жә¶ж¶ІдёӯHпјӢзҡ„жө“еәҰпјҲеҒҮи®ҫжә¶ж¶ІдҪ“з§ҜдёҚеҸҳпјүжҳҜпјҲ пјү A. 1.5mol/L B. 0.75mol/L C. 0.5mol/L D. 0.25mol/L |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҜйҖҶеҸҚеә”2NO2 в‘ еҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗnmolO2зҡ„еҗҢж—¶з”ҹжҲҗ2nmolNO2 в‘ЎеҚ•дҪҚж—¶й—ҙеҶ…з”ҹжҲҗnmolO2зҡ„еҗҢж—¶з”ҹжҲҗ2nmolNO в‘ўз”ЁNO2гҖҒNOгҖҒO2зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮд№ӢжҜ”дёә2:2:lзҡ„зҠ¶жҖҒ в‘Јж··еҗҲж°”дҪ“зҡ„йўңиүІдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ в‘Өж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ в‘Ҙж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёҚеҶҚж”№еҸҳзҡ„зҠ¶жҖҒ A. в‘ в‘Јв‘Ҙ B. в‘Ўв‘ўв‘Ө C. в‘ в‘ўв‘Ј D. в‘ в‘Ўв‘ўв‘Јв‘Өв‘Ҙ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжё©еәҰдёӢпјҢеңЁдҪ“з§Ҝдёә10Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢ3molXе’Ң1molYиҝӣиЎҢеә”пјҡ2XпјҲgпјү+YпјҲgпјү A. д»ҘXжө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮдёә0.01 mol/пјҲLВ·sпјү B. е°Ҷе®№еҷЁдҪ“з§ҜеҸҳдёә20LпјҢZзҡ„е№іиЎЎжө“еәҰдёәеҺҹжқҘзҡ„1/2 C. иӢҘеўһеӨ§еҺӢејәпјҢеҲҷзү©иҙЁYзҡ„иҪ¬еҢ–зҺҮеҮҸе°Ҹ D. иӢҘеҚҮй«ҳжё©еәҰпјҢXзҡ„дҪ“з§ҜеҲҶж•°еўһеӨ§пјҢеҲҷиҜҘеҸҚеә”зҡ„в–іH<0 |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҜҶй—ӯе®№еҷЁдёӯиҝӣиЎҢеҰӮдёӢеҸҚеә”пјҡ2SO2(g) +O2(g) A. SO2дёә0.4mol/L B. SO2дёә 0.25mol/L C. SO2гҖҒSO3еқҮдёә0.15mol/L D. SO3дёә0.4mol/L |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
е°ҶеҰӮеӣҫжүҖзӨәе®һйӘҢиЈ…зҪ®зҡ„Kй—ӯеҗҲпјҢдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ A. з”өеӯҗжІҝZnвҶ’aвҶ’bвҶ’Cuи·Ҝеҫ„жөҒеҠЁ B. зүҮеҲ»еҗҺеҸҜи§ӮеҜҹеҲ°ж»ӨзәёbзӮ№еҸҳзәўиүІ C. зүҮеҲ»еҗҺз”Іжұ дёӯcпјҲSO42вҖ”пјүеўһеӨ§ D. Cuз”өжһҒдёҠеҸ‘з”ҹиҝҳеҺҹеҸҚеә” |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зі•зӮ№еҢ…иЈ…дёӯеёёи§Ғзҡ„и„ұж°§еүӮз»„жҲҗдёәиҝҳеҺҹжҖ§й“ҒзІүгҖҒж°ҜеҢ–й’ гҖҒзӮӯзІүзӯүпјҢе…¶и„ұж°§еҺҹзҗҶдёҺй’ўй“Ғзҡ„еҗёж°§и…җиҡҖзӣёеҗҢгҖӮдёӢеҲ—еҲҶжһҗжӯЈзЎ®зҡ„жҳҜ A. и„ұж°§иҝҮзЁӢжҳҜеҗёзғӯеҸҚеә”пјҢеҸҜйҷҚдҪҺжё©еәҰпјҢ延й•ҝзі•зӮ№дҝқиҙЁжңҹ B. и„ұж°§иҝҮзЁӢдёӯй“ҒдҪңеҺҹз”өжұ жӯЈжһҒпјҢз”өжһҒеҸҚеә”дёәпјҡFe-3eвҶ’Fe3+ C. и„ұж°§иҝҮзЁӢдёӯзўіеҒҡеҺҹз”өжұ иҙҹжһҒпјҢз”өжһҒеҸҚеә”дёәпјҡ2H2O+O2+4eвҶ’4OH- D. еҗ«жңү1пјҺ12gй“ҒзІүзҡ„и„ұж°§еүӮпјҢзҗҶи®әдёҠжңҖеӨҡиғҪеҗёж”¶ж°§ж°”336mLпјҲж ҮеҮҶзҠ¶еҶөпјү |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
жҹҗеҢ–еӯҰе°Ҹз»„жһ„жғіе°ҶжұҪиҪҰе°ҫж°”(NOгҖҒNO2)иҪ¬еҢ–дёәйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷHNO3пјҢ е…¶еҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢе…¶дёӯAгҖҒBдёәеӨҡеӯ”жқҗж–ҷгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. з”өи§ЈиҙЁжә¶ж¶Ідёӯз”өжөҒзҡ„ж–№еҗ‘з”ұBеҲ°AпјҢз”өеӯҗзҡ„жөҒеҗ‘дёҺд№ӢзӣёеҸҚ B. з”өжһҒAиЎЁйқўеҸҚеә”д№ӢдёҖдёәNO-3e-+2H2O=NO3-+4H+ C. з”өжһҒBйҷ„иҝ‘зҡ„c(NO3-)еўһеӨ§ D. иҜҘз”өжұ е·ҘдҪңж—¶пјҢжҜҸиҪ¬з§»4 molз”өеӯҗпјҢж¶ҲиҖ—22.4 L O2 |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗеҺҹз”өжұ жҖ»еҸҚеә”зҰ»еӯҗж–№зЁӢејҸдёә2Fe3пјӢпјӢFe=3Fe2пјӢпјҢйғҪдёҚиғҪе®һзҺ°иҜҘеҸҚеә”зҡ„еҺҹз”өжұ жҳҜ в‘ жӯЈжһҒдёәCuпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәFeCl3жә¶ж¶Іпјӣ в‘ЎжӯЈжһҒдёәCпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәFe(NO3)3жә¶ж¶Іпјӣ в‘ўжӯЈжһҒдёәFeпјҢиҙҹжһҒдёәZnпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәFe2(SO4)3жә¶ж¶Іпјӣ в‘Ј жӯЈжһҒдёәAgпјҢиҙҹжһҒдёәFeпјҢз”өи§ЈиҙЁжә¶ж¶ІдёәCuSO4жә¶ж¶І A. в‘ B. в‘ўв‘Ј C. в‘ в‘Ў D. в‘Ўв‘ўв‘Ј |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®жЁЎжӢҹз”өи§ЈеҺҹзҗҶеңЁе·Ҙдёҡз”ҹдә§дёҠзҡ„еә”з”ЁгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. ж°Ҝзўұе·ҘдёҡдёӯпјҢXз”өжһҒдёҠеҸҚеә”ејҸжҳҜ4OH--4e-=2H2O+O2вҶ‘ B. з”өи§ЈзІҫзӮјй“ңж—¶пјҢZжә¶ж¶Ідёӯзҡ„й“ңзҰ»еӯҗжө“еәҰдёҚеҸҳ C. еңЁй“ҒзүҮдёҠй•Җй“ңж—¶пјҢYжҳҜзәҜй“ң D. з”өи§Јж°ҙеҲ¶ж°ўж°”ж—¶пјҢZеҸҜд»ҘжҳҜзЁҖзЎ«й…ёжә¶ж¶І |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁеҜҶй—ӯе®№еҷЁдёӯпјҢдёҖе®ҡйҮҸж··еҗҲж°”дҪ“еҸ‘з”ҹдёӢеҲ—еҸҚеә”пјҡaA(g) + bB(g) A. Cзҡ„дҪ“з§ҜеҲҶж•°еўһеӨ§ B. е№іиЎЎеҗ‘еҸіз§»еҠЁ C. Bзҡ„иҪ¬еҢ–зҺҮжҸҗй«ҳ D. a+b < c+d |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еңЁе®№з§ҜдёҚеҸҳзҡ„еҜҶй—ӯе®№еҷЁдёӯеӯҳеңЁеҰӮдёӢеҸҚеә”пјҡ2SO2(g)пјӢO2(g)  A. еӣҫв… з ”з©¶зҡ„жҳҜt0ж—¶еҲ»еўһеӨ§O2зҡ„жө“еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ B. еӣҫв…Ўз ”з©¶зҡ„жҳҜt0ж—¶еҲ»еҠ е…ҘеӮ¬еҢ–еүӮеҗҺеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ C. еӣҫв…ўз ”з©¶зҡ„жҳҜеӮ¬еҢ–еүӮеҜ№е№іиЎЎзҡ„еҪұе“ҚпјҢдё”з”Ізҡ„еӮ¬еҢ–ж•ҲзҺҮжҜ”д№ҷй«ҳ D. еӣҫв…ўз ”з©¶зҡ„жҳҜжё©еәҰеҜ№еҢ–еӯҰе№іиЎЎзҡ„еҪұе“ҚпјҢдё”д№ҷзҡ„жё©еәҰиҫғдҪҺ |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҸҜйҖҶеҸҚеә”mA(s)+nB(g) A. иҫҫеҲ°е№іиЎЎеҗҺпјҢиӢҘдҪҝз”ЁеӮ¬еҢ–еүӮпјҢCзҡ„дҪ“з§ҜеҲҶж•°е°ҶеўһеӨ§ B. еҪ“е№іиЎЎеҗҺпјҢиӢҘжё©еәҰеҚҮй«ҳпјҢеҢ–еӯҰе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ C. еҢ–еӯҰж–№зЁӢејҸдёӯпјҢnпјһe+f D. иҫҫеҲ°е№іиЎЎеҗҺпјҢеўһеҠ Aзҡ„иҙЁйҮҸжңүеҲ©дәҺеҢ–еӯҰе№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁ |
|
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||
и®ҫеҸҚеә”в‘ Fe(s)пјӢCO2(g)
|
||||||||||
| 19. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
жҹҗе…ҙи¶Је°Ҹз»„дёәжҺўз©¶жё©еәҰгҖҒеҺӢејәеҜ№еҸҜйҖҶеҸҚеә”A(g)пјӢB(g)
|
|||||||||||||||||||||
| 20. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҸҚеә”йҷҗеәҰзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A. дҪҝз”ЁеӮ¬еҢ–еүӮпјҢеҸҜйҷҚдҪҺеҸҚеә”зҡ„жҙ»еҢ–иғҪпјҢеҠ еҝ«еҸҚеә”йҖҹзҺҮпјҢж”№еҸҳеҸҚеә”йҷҗеәҰ B. дҫқжҚ®з„“еҲӨжҚ®пјҡNH4HCO3еҸ—зғӯеҲҶи§ЈеҸҜиҮӘеҸ‘иҝӣиЎҢ C. еӨ§еӨҡж•°еҢ–еӯҰеҸҚеә”еңЁдёҖе®ҡжқЎд»¶дёӢйғҪжңүдёҖе®ҡзҡ„йҷҗеәҰ D. FeCl3дёҺKSCNеҸҚеә”иҫҫеҲ°е№іиЎЎж—¶пјҢеҗ‘е…¶дёӯж»ҙеҠ е°‘йҮҸKClжә¶ж¶ІпјҢеҲҷжә¶ж¶ІйўңиүІеҸҳж·ұ |
|
| 21. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡжқЎд»¶дёӢпјҢжҹҗеҸҚеә”иҫҫеҲ°е№іиЎЎпјҢе…¶е№іиЎЎеёёж•°дёә A. иҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡNO2пјӢCO = CO2пјӢNO B. иҜҘеҸҚеә”зҡ„з„“еҸҳдёәиҙҹеҖј C. еҚҮй«ҳжё©еәҰпјҢжӯЈеҸҚеә”йҖҹзҺҮеҮҸе°Ҹ D. жҒ’жё©ж—¶пјҢеўһеӨ§еҺӢејәпјҢйўңиүІеҠ ж·ұпјҢеӣ е№іиЎЎе·Ұ移 |
|
| 22. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҸҚеә”4NH3(g)пјӢ5O2(g) A. П…(NH3)пјқ0.010molпјҸ(LВ·s) B. П…(O2)пјқ0.0010molпјҸ(LВ·s) C. П…(NO)пјқ0.0010molпјҸ(LВ·s) D. П…(H2O)пјқ0.045molпјҸ(LВ·s) |
|
| 23. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
вҖңзҘһиҲҹдёғеҸ·вҖқжҲҗеҠҹзҷ»еӨ©ж Үеҝ—зқҖжҲ‘еӣҪзҡ„иҲӘеӨ©дәӢдёҡиҝӣе…ҘдәҶж–°зҡ„зҜҮз« гҖӮ пјҲ1пјүжҹҗз©әй—ҙз«ҷеұҖйғЁиғҪйҮҸиҪ¬еҢ–зі»з»ҹеҰӮдёӢеӣҫжүҖзӨәпјҢе…¶дёӯзҮғж–ҷз”өжұ йҮҮз”ЁKOHжә¶ж¶Ідёәз”өи§Јж¶ІпјҢзҮғж–ҷз”өжұ ж”ҫз”өж—¶зҡ„иҙҹжһҒеҸҚеә”ејҸдёә___________________________________гҖӮеҰӮжһңжҹҗж®өж—¶й—ҙеҶ…ж°ўж°§еӮЁзҪҗдёӯе…ұ收йӣҶеҲ°33.6 L(е·ІжҠҳз®—жҲҗж ҮеҶө)ж°”дҪ“пјҢеҲҷиҜҘж®өж—¶й—ҙеҶ…ж°ҙз”өи§Јзі»з»ҹдёӯиҪ¬з§»з”өеӯҗзҡ„зү©иҙЁ зҡ„йҮҸдёә_________molгҖӮ  пјҲ2пјүеңЁиҪҪдәәиҲӘеӨ©еҷЁзҡ„з”ҹжҖҒзі»з»ҹдёӯпјҢдёҚд»…иҰҒжұӮеҲҶзҰ»еҮәCO2пјҢиҝҳиҰҒжұӮжҸҗдҫӣе……и¶ізҡ„O2гҖӮжҹҗз§Қз”өеҢ–еӯҰиЈ…зҪ®еҸҜе®һзҺ°иҪ¬еҢ–2CO2 =2COпјӢO2пјҢCOеҸҜз”ЁдҪңзҮғж–ҷгҖӮе·ІзҹҘиҜҘеҸҚеә”зҡ„йҳіжһҒеҸҚеә”ејҸдёә4OHпјҚпјҚ4eпјҚ=O2вҶ‘пјӢ2H2OпјҢеҲҷйҳҙжһҒеҸҚеә”ејҸдёә________________________гҖӮ |
|
| 24. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
й“ңдёҺзЁҖзЎ«й…ёдёҚеҸҚеә”пјҢжҹҗж Ўе®һйӘҢе°Ҹз»„зҡ„еҗҢеӯҰеңЁиҖҒеёҲзҡ„жҢҮеҜјдёӢи®ҫи®ЎдәҶдёӢеҲ—иЈ…зҪ®пјҢе®һзҺ°дәҶй“ңдёҺзЁҖзЎ«й…ёзҡ„еҸҚеә”гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ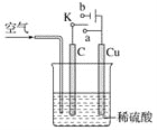 пјҲ1пјүз”ІеҗҢеӯҰи®ӨдёәпјҢдёҚйҖҡе…Ҙз©әж°”пјҢе°ҶKдёҺ______(еЎ«вҖңaвҖқжҲ–вҖңbвҖқ)иҝһжҺҘпјҢеҚіеҸҜе®һзҺ°гҖӮеҲҷCuжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёә________________________пјҢжҖ»еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә________________________гҖӮ пјҲ2пјүд№ҷеҗҢеӯҰи®ӨдёәеңЁйҖҡе…Ҙз©әж°”зҡ„еҗҢж—¶пјҢе°ҶејҖе…іKдёҺ____(еЎ«вҖңaвҖқжҲ–вҖңbвҖқ)иҝһжҺҘпјҢд№ҹеҸҜд»Ҙе®һзҺ°гҖӮз”өжұ жҖ»еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_______________________________________гҖӮ |
|
| 25. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ298 Kж—¶пјҢ1 mol C2H5OHеңЁж°§ж°”дёӯе®Ңе…ЁзҮғзғ§з”ҹжҲҗдәҢж°§еҢ–зўіе’Ңж¶ІжҖҒж°ҙж”ҫеҮәзғӯйҮҸ1366.8 kJгҖӮ пјҲ1пјүеҶҷеҮәиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ________________________________________гҖӮ пјҲ2пјүеҰӮеӣҫе°ҶжӯӨеҸҚеә”и®ҫи®ЎдёәеҺҹз”өжұ пјҢд№ҷжұ дёӯзҡ„дёӨдёӘз”өжһҒдёҖдёӘжҳҜзҹіеўЁз”өжһҒпјҢдёҖдёӘжҳҜй“Ғз”өжһҒгҖӮе·ҘдҪңж—¶MгҖҒNдёӨдёӘз”өжһҒзҡ„иҙЁйҮҸйғҪдёҚеҮҸе°‘пјҢд№ҷжұ дёӯжҖ»еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡ_________________пјҢдёҖж®өж—¶й—ҙеҗҺпјҢжөӢеҫ—д№ҷжұ дёӯжҹҗдёҖз”өжһҒиҙЁйҮҸеўһеҠ 4.32gж—¶пјҢзҗҶи®әдёҠз”Іжұ ж¶ҲиҖ—ж°§ж°”дҪ“з§ҜдёәпјҲж ҮеҮҶзҠ¶еҶөпјү__________mLгҖӮ  |
|
| 26. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘж°ҙжә¶ж¶ІдёӯCrO42-пјҲй»„иүІпјүе’Ң Cr2O72-пјҲж©ҷиүІпјүй—ҙеӯҳеңЁеҰӮдёӢе№іиЎЎпјҡ2CrO42-пјӢ2HпјӢ пјҲ1пјүиҜҘеҸҚеә”е№іиЎЎеёёж•°зҡ„иЎЁиҫҫејҸдёә_______________________ пјҲ2пјүдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ_________ AгҖҒVжӯЈпјҲCrO42вҖ”пјү=2VйҖҶпјҲCr2O72вҖ”пјүиҜҙжҳҺиҜҘеҸҚеә”е·Іиҫҫе№іиЎЎзҠ¶жҖҒ BгҖҒжә¶ж¶ІйўңиүІдёҚеҸҳиҜҙжҳҺиҜҘеҸҚеә”е·Іиҫҫе№іиЎЎзҠ¶жҖҒ CгҖҒжә¶ж¶ІдёӯcпјҲCrO42вҖ”пјүпјҡcпјҲCr2O72вҖ”пјү=2:1ж—¶иҜҘеҸҚеә”е·Іиҫҫе№іиЎЎзҠ¶жҖҒ DгҖҒеҚҮжё©иҜҘеҸҚеә”е№іиЎЎеёёж•°еҸҳеӨ§ EгҖҒеҗ‘е№іиЎЎеҗҺзҡ„дҪ“зі»дёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„ж°ҙпјҢе№іиЎЎдёҚ移еҠЁ пјҲ3пјүж №жҚ®2CrO42-пјӢ2HпјӢ  пјҲ4пјүH+(aqпјү+OH-пјҲaqпјү=H2O(lпјүпјӣ О”H= -a KJ/mol 3Cl2пјҲgпјү+2Cr3+пјҲaqпјү+16OH-(aqпјү=2CrO42-пјҲaqпјү+6Cl-пјҲaqпјү+8H2O(l)пјӣО”H= -b KJ/mol 2CrO42-пјҲaqпјү+2H+(aqпјү е·ІзҹҘй…ёжҖ§жқЎд»¶дёӢCr2O72вҖ”е°ҶCl-ж°§еҢ–дёәCl2пјҢжң¬иә«иў«иҝҳеҺҹдёәCr3+пјҢиҜ•еҶҷеҮәиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ_______________________________________________________________ |
|
| 27. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҜ№дәҺA(?)+2B(g) пјҲ1пјүеўһеҺӢпјҢе№іиЎЎдёҚ移еҠЁпјҢеҪ“nпјқ3ж—¶пјҢAзҡ„зҠ¶жҖҒдёә______________пјӣ пјҲ2пјүиӢҘAдёәеӣәжҖҒпјҢеўһеӨ§еҺӢејәпјҢCзҡ„зҷҫеҲҶеҗ«йҮҸеўһеҠ пјҢеҲҷnпјқ________пјӣ пјҲ3пјүеҚҮжё©пјҢе№іиЎЎеҗ‘еҸіз§»еҠЁпјҢеҲҷиҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”дёә______________еҸҚеә”(еЎ«ж”ҫзғӯжҲ–еҗёзғӯ)гҖӮ |
|
| 28. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ |
жё©е®Өж•Ҳеә”е’Ңиө„жәҗзҹӯзјәзӯүй—®йўҳе’ҢеҰӮдҪ•йҷҚдҪҺеӨ§ж°”дёӯзҡ„CO2еҗ«йҮҸ并еҠ д»ҘејҖеҸ‘еҲ©з”Ёеј•иө·дәҶеҗ„еӣҪзҡ„жҷ®йҒҚйҮҚи§ҶгҖӮзӣ®еүҚе·ҘдёҡдёҠжңүдёҖз§Қж–№жі•жҳҜз”ЁCO2з”ҹдә§зҮғж–ҷз”ІйҶҮгҖӮдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҡCO2(g)пјӢ3H2(g)  пјҲ1пјүе…ідәҺиҜҘеҸҚеә”зҡ„дёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜ________гҖӮ AпјҺО”H>0пјҢО”S>0 BпјҺО”H>0пјҢО”S<0 CпјҺО”H<0пјҢО”S<0 DпјҺО”H<0пјҢО”S>0 пјҲ2пјүдёәжҺўз©¶еҸҚеә”еҺҹзҗҶпјҢзҺ°иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡеңЁдҪ“з§Ҝдёә1 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢе……е…Ҙ1mol CO2е’Ң3mol H2пјҢжөӢеҫ—CO2е’ҢCH3OH(g)зҡ„жө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–еҰӮдёӢеӣҫжүҖзӨәгҖӮд»ҺеҸҚеә”ејҖе§ӢеҲ°е№іиЎЎпјҢз”Ёж°ўж°”жө“еәҰеҸҳеҢ–иЎЁзӨәзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮv(H2)____________________пјҢ CO2иҪ¬еҢ–зҺҮдёә_________гҖӮзӣёеҗҢжё©еәҰдёӢпјҢжҹҗдёҖж—¶еҲ»иӢҘиҜҘе®№еҷЁдёӯеҗ«жңү1mol H2гҖҒ1.2mol CO2гҖҒ0.8 mol CH3OHгҖҒ1.5mol H2OпјҢеҲҷжӯӨж—¶еҸҚеә”жүҖеӨ„зҡ„зҠ¶жҖҒдёә___________________________ (еЎ«вҖңеҗ‘жӯЈеҸҚеә”ж–№еҗ‘иҝӣиЎҢдёӯвҖқгҖҒ вҖңеҗ‘йҖҶеҸҚеә”ж–№еҗ‘иҝӣиЎҢдёӯвҖқжҲ–вҖңе№іиЎЎзҠ¶жҖҒвҖқ)пјҢзҗҶз”ұ______________________________________гҖӮ  пјҲ3пјүеңЁжё©еәҰе®№з§ҜдёҚеҸҳзҡ„жқЎд»¶дёӢпјҢиғҪиҜҙжҳҺиҜҘеҸҚеә”е·Іиҫҫе№іиЎЎзҠ¶жҖҒзҡ„жҳҜ________(еЎ«еҶҷеәҸеҸ·еӯ—жҜҚ)пјҡ aпјҺn(CO2)вҲ¶n(H2)вҲ¶n(CH3OH)вҲ¶n(H2O)пјқ1вҲ¶3вҲ¶1вҲ¶1 bпјҺе®№еҷЁеҶ…еҺӢејәдҝқжҢҒдёҚеҸҳ cпјҺе®№еҷЁеҶ…зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳ dпјҺH2зҡ„ж¶ҲиҖ—йҖҹзҺҮдёҺCH3OHзҡ„ж¶ҲиҖ—йҖҹзҺҮд№ӢжҜ”дёә3вҲ¶1 пјҲ4пјүдёӢеҲ—жқЎд»¶иғҪдҪҝдёҠиҝ°еҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮеўһеӨ§пјҢдё”е№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁзҡ„жҳҜ________(еӯ—жҜҚ)гҖӮ aпјҺеҸҠж—¶еҲҶзҰ»еҮәCH3OHж°”дҪ“ bпјҺйҖӮеҪ“еҚҮй«ҳжё©еәҰ cпјҺдҝқжҢҒе®№еҷЁзҡ„е®№з§ҜдёҚеҸҳпјҢеҶҚе……е…Ҙ1 mol CO2е’Ң3 mol H2 dпјҺйҖүжӢ©й«ҳж•Ҳзҡ„еӮ¬еҢ–еүӮ |
|
| 29. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁ1.5Lзҡ„еҜҶй—ӯе®№еҷЁдёӯйҖҡе…Ҙ2molX2е’Ң3molY2зҡ„ж··еҗҲж°”дҪ“пјҢеңЁдёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”:X2(g)+3Y2(g) пјҲ1пјүиҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°еҖјдёә_______ пјҲ2пјүдёәжҸҗй«ҳX2зҡ„е№іиЎЎиҪ¬еҢ–зҺҮпјҢдёӢеҲ—жҺӘж–ҪеҸҜиЎҢзҡ„жҳҜ___________ a.еҗ‘дҪ“зі»дёӯеҶҚйҖҡе…ҘдёҖе®ҡйҮҸзҡ„X2 b.йҷҚжё© c.移еҮәйғЁеҲҶZ d.еҶҚеҶІе…ҘдёҖе®ҡйҮҸAr e.еўһеӨ§е®№еҷЁдҪ“з§Ҝ пјҲ3пјүеҸҚеә”иҫҫе№іиЎЎеҗҺпјҢt1ж—¶еҲ»ж”№еҸҳжқЎд»¶пјҢйҖҹзҺҮйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢеҲҷt1еҜ№еә”жқЎд»¶ж”№еҸҳдёә_______  a. еҚҮжё© b. еҗ‘дҪ“зі»дёӯеҶҚйҖҡе…ҘдёҖе®ҡйҮҸзҡ„W c. 移иө°йғЁеҲҶX2гҖҒY2 d.еҮҸе°Ҹе®№еҷЁзҡ„дҪ“з§Ҝ |
|
- еӨ©ж°ҙеёӮй«ҳдәҢеҢ–еӯҰеҒҮжңҹдҪңдёҡпјҲ2017е№ҙдёҠеҶҢпјүиҜ•еҚ·еёҰи§ЈжһҗеҸҠзӯ”жЎҲ
- 2019еұҠй«ҳдёүеүҚеҚҠжңҹжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲж№–еҚ—зңҒй•ҝжІҷеёӮйӣ…зӨјдёӯеӯҰпјү
- иҝҗеҹҺеёӮ2019е№ҙй«ҳдәҢдёӢжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•еңЁзәҝе…Қиҙ№иҖғиҜ•
- жІіеҚ—зңҒдҝЎйҳій«ҳзә§дёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҶҢ1жңҲжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·
- дҝЎйҳій«ҳзә§дёӯеӯҰ2018е№ҙй«ҳдәҢеҢ–еӯҰеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•еңЁзәҝе…Қиҙ№иҖғиҜ•
- 2018-2019е№ҙй«ҳдёҖеҗҺеҚҠжңҹ3жңҲжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲжІіеҚ—зңҒж°ёеҹҺеёӮе®һйӘҢй«ҳзә§дёӯеӯҰпјү
- жұҹиҘҝзңҒеҚ—жҳҢеёӮж–°е»әдёҖдёӯ2020-2021е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- е®үеҫҪзңҒе®үеәҶеёӮжҖҖе®ҒеҺҝ第дәҢдёӯеӯҰ2021еұҠй«ҳдёүдёҠеҶҢ第дә”ж¬ЎжңҲиҖғеҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ



