运城市高三化学2019年前半期月考测验附答案与解析
| 1. | 详细信息 |
|
已知氧化剂、稀酸等都能迅速破坏传染病毒活性而杀死病毒,下列物质不能作为常用消毒剂的是 A.H2O2溶液 B.NaClO溶液 C.SO2 D.醋酸 |
|
| 2. | 详细信息 |
|
下列物质中不能用化合反应的方法制得的是( ) ①SiO2 ②H2SiO3 ③Na2O2 ④Al(OH)3 ⑤FeCl3 ⑥CaSiO3 A. ①③⑤ B. ②④⑥ C. ②⑤ D. ②和④ |
|
| 3. | 详细信息 |
|
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是: A. 氧化剂 B. 还原剂 C. 催化剂 D. 载体 |
|
| 4. | 详细信息 | |||||||||||||||
除去下列物质中所含的杂质。选用的试剂正确的是( )
|
||||||||||||||||
| 5. | 详细信息 |
|
某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH 溶液,开始有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是 A. 一定有Fe2+,一定没有Mg2+、Fe3+ B. 一定有Fe3+,一定没有Mg2+、Fe2+ C. 一定有Fe3+,可能有Fe2+,一定没有Mg2+ D. 一定有Fe2+,可能有Mg2+,一定没有Fe3+ |
|
| 6. | 详细信息 |
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )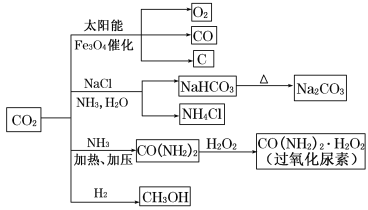 A.CO2经催化分解为C、CO、O2的反应为放热反应 B.除去Na2CO3固体中少量NaHCO3可用热分解的方法 C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同 D.由CO2和H2合成甲醇,原子利用率达100% |
|
| 7. | 详细信息 | ||||||||||||||||||||
用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
|
|||||||||||||||||||||
| 8. | 详细信息 |
|
能正确表示下列反应的离子方程式的是( ) A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+= Fe2++2Fe3++4H2O B.NH4HCO3溶液与足量NaOH溶液混合:HCO3-+Na++ OH-=CO32-+ H2O C.将过量的SO2通入NaClO溶液中:SO2+ClO-+ H2O= HClO+HSO3- D.将0.2mol•L-1KAl(SO4)2溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3 ↓+ 3BaSO4↓ |
|
| 9. | 详细信息 |
|
下列对氯及其化合物的说法正确的是( ) A. 过量的铁在氯气中燃烧可生成氯化亚铁 B. 用pH试纸测得氯水的pH=4 C. 溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色 D. 由Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO可推出Ca(ClO)2+SO2+H2O===CaSO3↓+2HClO |
|
| 10. | 详细信息 |
|
溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘。提取碘的途径如下所示: 干海带 下列有关叙述正确的是( ) A. 碘元素在海水中也有游离态存在 B. 在提取的过程中用的氧化剂可以是H2O2 C. 操作A是结晶或重结晶 D. B是提纯操作,常用蒸馏或分馏 |
|
| 11. | 详细信息 |
对实验Ⅰ~Ⅳ的实验现象预测正确的是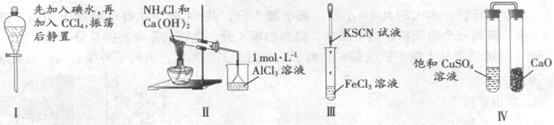 A. 实验I:液体分层,下层呈无色 B. 实验II:烧杯中先出现白色沉淀,后溶解 C. 实验III:试管中溶液颜色变为红色 D. 实验IV:放置一段时间后,饱和硫酸铜溶液中出现蓝色晶体 |
|
| 12. | 详细信息 |
|
下列说法正确的是( ) A. 在粗硅的制取中发生2C+SiO2 B. 盛放NaOH溶液时,使用带玻璃塞的磨口瓶 C. 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 D. 由Na2CO3+SiO2 |
|
| 13. | 详细信息 |
|
某溶液中可能含有SO42-、 CO32-、Cl-、SO32-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )。 A. H2SO4 B. HCl C. NaOH D. HNO3 |
|
| 14. | 详细信息 |
|
下列化学实验中,能证明某种中学常见气体为SO2的是( )。 ①能使澄清的石灰水变浑浊;②能使湿润的蓝色石蕊试纸变红;③既能使品红溶液褪色又能使澄清的石灰水变浑浊;④将其通入足量的NaOH溶液中,再滴加BaCl2溶液,有白色沉淀生成,该沉淀溶于稀盐酸;⑤通入溴水,能使溴水褪色,再滴加Ba(NO3)2溶液,有白色沉淀。 A. 都能证明 B. 都不能证明 C. ③⑤能证明 D. 只有⑤能证明 |
|
| 15. | 详细信息 |
|
有关实验的说法中正确的是( ) A. 除去铁粉中的铜粉,加入足量浓硫酸加热反应后进行过滤 B. 不用任何其他试剂就可以鉴别NaOH溶液和Al2(SO4)3溶液 C. 制备Fe(OH)3胶体时,通常是将Fe(OH)3固体溶于沸水中 D. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
|
| 16. | 详细信息 |
|
在溶液中加入足量Na2O2后仍能大量共存的离子组是 A. C. Ca2+、Mg2+、 |
|
| 17. | 详细信息 |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( ) A. 原混合溶液中的CO2-3与AlO-2的物质的量之比为1:2 B. V1:V2=1:5 C. M点时生成的CO2为0.05mol D. a曲线表示的离子方程式为:AlO-2+H++H2O=Al(OH)3↓ |
|
| 18. | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( ) A. 11.2g B. 5.6g C. 2.8g D. 无法计算 |
|
| 19. | 详细信息 |
|
只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质)写出试剂或操作的名称、方法及有关的化学方程式或离子方程式: (1)Fe2O3(Al2O3)_________________;离子方程式__________。 (2)Fe2O3[Fe(OH)3]________;化学方程式_______________。 (3)FeSO4溶液(CuSO4)_____________;离子方程式_________。 (4)FeCl3溶液(FeCl2)_____________;离子方程式__________。 |
|
| 20. | 详细信息 |
|
亚硫酸钠中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、Na2S溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。 (1)要证明Na2SO3具有还原性,应选用的试剂有______,看到的现象是_______,反应的化学方程式为__________。 (2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是________,反应的化学方程式为___________。 |
|
| 21. | 详细信息 |
|
某课外活动小组的同学在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫;而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该反应装置已略去): 试回答: 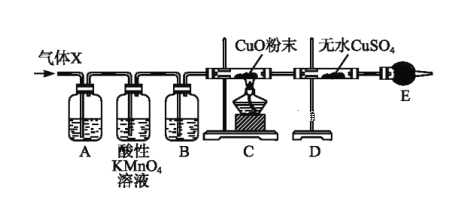 (1)上述实验中生成二氧化硫气体的化学方程式为_________。 (2)乙同学认为还可能产生氢气的理由是__________。 (3)丙同学在安装好装置后,必不可少的一步操作是__________。 (4)B中加入的试剂是______,其作用是___________。 (5)可以证明气体X中含有氢气的实验现象是;C中______,D中______。如果撤去装置B,是否还能根据D中的现象判断气体X中含有氢气?___________ 为什么?_______________________________________________________________ |
|
| 22. | 详细信息 |
我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下: (1) 上述生产纯碱的方法称________________,副产品的一种用途为____________。 (2) 沉淀池中发生的化学反应方程式是____________________________________。 (3) 写出上述流程中X物质的分子式________________。 (4) 使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是____________。 (5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________________________________________________________。 (6) 向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。 (a) 增大NH4+的浓度,使NH4Cl更多地析出 (b) 使NaHCO3更多地析出 (c) 使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度 |
|
| 23. | 详细信息 |
以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁的生产流程示意图: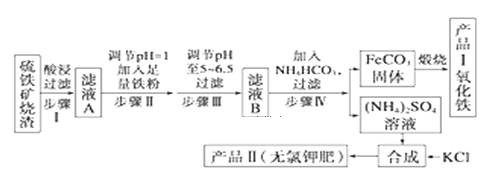 回答下列问题: (1))古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母) a.Fe b.FeO c.Fe2O3 d.Fe3O4 (2)酸浸、过滤后滤液A中的金属阳离子是_________,检验其中较低价态的阳离子所用试剂为________(填化学式)。煅烧FeCO3生成产品Ⅰ的化学反应方程式为_______________ (3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为_______,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是 _____、趁热过滤、洗涤、干燥. 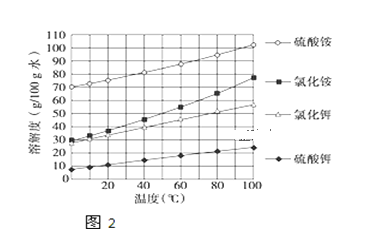 (4)进一步提纯产品Ⅱ的方法是;__________________ (5)步骤IV反应的离子方程式__________ |
|
最近更新



