2016-2017年高二上半期化学期末考试考题带答案和解析(重庆市万州二中)
| 1. | 详细信息 |
|
下列有关电池的说法不正确的是( ) A.手机上用的锂离子电池属于二次电池 B.铁件上镀铜,镀件连接电源的正极,用含Cu2+的盐溶液作电解质溶液 C.甲醇燃料电池可把化学能转化为电能 D.锌锰干电池中,锌电极是负极 |
|
| 2. | 详细信息 |
|
下列说法或表示方法正确的是( ) A.等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 B.氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)?2H2O(l)△H=?285.8 kJ/mol C.2H2(g)+O2(g)?2H2O(l)△H=?Q1 kJ/mol 2H2(g)+O2(g)?2H2O(g)△H=?Q2 kJ/mol,则Q1>Q2 D.已知中和热为57.3 kJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.对于反应:H2(g)+Cl2(g)=2HCl (g)△H=?a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 B.2MnO(s)+O2(g)?2MnO2(s),该反应在低温下能自发进行,则其△H<0 C.用干燥的pH试纸测得某氯水的pH=3.1 D.航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀 |
|
| 4. | 详细信息 |
|
下列有机物命名正确的是( ) A. B.CH3CH2CH2OH 1?丙醇 C. D. |
|
| 5. | 详细信息 |
对图两种化合物的结构或性质描述正确的是( ) 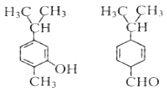 A.不是同分异构体 B.分子中共平面的碳原了数相同 C.含氧官能团的性质不同 D.可用红外光谱区分,但不能用核磁共振氢谱区分 |
|
| 6. | 详细信息 |
|
对于反应:N2+3H2?2NH3△H<0,下列叙述正确的是( ) A.升高温度,逆反应速率加快,正反应速率减慢 B.使用催化剂比不使用催化剂化学平衡常数要大 C.由勒夏特列原理可知合成氨时,分离出NH3可以提高原料利用率 D.加压能加快反应速率,因为增加了活化分子百分数 |
|
| 7. | 详细信息 |
|
在一个固定容积的密闭容器中充入2molNO2 , 一定温度下建立如下平衡:2NO2 A.x>y B.x<y C.x=y D.不能确定 |
|
| 8. | 详细信息 |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O 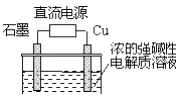 A.石墨电极上产生氧气 B.铜电极发生还原反应 C.铜电极接直流电源的正极 D.当有0.1mol电子转移时,有0.1molCu2O生成 |
|
| 9. | 详细信息 |
|
常温下,下列各组离子在相应的条件下可能大量共存的是( ) A.pH=2的溶液中:S2O32?、K+、Cl?、Na+ B. C.在 D.由水电离产生的c(OH?)=1×10?12mol/L的溶液中:NO3?、Mg2+、Na+、SO42? |
|
| 10. | 详细信息 |
|
室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( ) A.溶液中导电粒子的数目减少 B.溶液中 C.醋酸的电离程度增大,c(H+)亦增大 D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
|
| 11. | 详细信息 |
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( ) 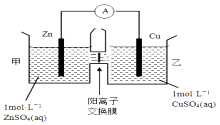 A.铜电极上发生还原反应 B.电池工作一段时间后,甲池的c(SO42?)不变 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
|
| 12. | 详细信息 |
关于下列装置说法正确的是( ) 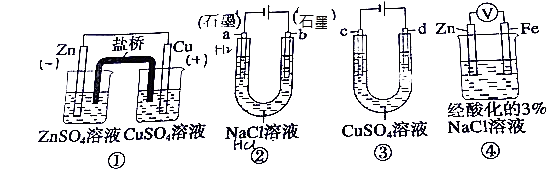 A.装置①中,盐桥中的K+移向ZnSO4溶液 B.装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色 C.用装置③精炼铜时,c极为粗铜 D.装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀 |
|
| 13. | 详细信息 |
|
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3?)=6.0mol?L?1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( ) A.原混合溶液中c(K+)为2mol?L?1 B.上述电解过程中共转移2mol电子 C.电解得到铜的物质的量为0.5mol D.电解后溶液中c(H+)为2mol?L?1 |
|
| 14. | 详细信息 |
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )  A.由图甲知,A点SO2的平衡浓度为0.4 mol/L B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
|
| 15. | 详细信息 |
|
已知2SO2 (g)+O2 (g)?2SO3 (g);△H=?197kJ?mol?1 . 向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3 . 恒温、恒容下反应达平衡时,下列关系一定正确的是( ) A.容器内压强P:P甲=P丙>2P乙 B.SO3的质量m:m甲=m丙>2m乙 C.c(SO2)与c(O2)之比k:k甲=k丙>k乙 D.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
|
| 16. | 详细信息 |
|
有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用. (1)有机物A是构成营养素的基础物质(含C、O、H、N等元素),A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: A的分子式是 , 含氧官能团的名称是 ; (2)将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. 该有机物的分子式为 , 该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式中的任意一种 .  |
|
| 17. | 详细信息 |
|
研究NOx、SO2、CO等大气污染气体的处理具有重要意义. (1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为. (2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如: ①CH4(g)+4NO2(g)?4NO(g)+CO2(g)+2H2O(g)△H1=?574kJ/mol ②CH4(g)+4NO(g)?2N2(g)+CO2(g)+2H2O(g)△H2 若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2= . (3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0 在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.  ①0~15min 内,v(CO2)= , 25℃时该反应平衡常数为 (该空保留2位小数); ②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是 (填选项序号). a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积 (4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3 . 已知NaHSO3溶液同时存在以下两种平衡: ①HSO3SO32?+H+ , ②HSO3?+H2O?H2SO3+OH?;常温下,0.1 mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3) c(SO32?)(填“>”、“=”或“<”). |
|
| 18. | 详细信息 |
|
工业废水中常含有一定量的Cr2O72?和CrO42? , 它们会对人类及生态系统产生很大的伤害,必须进行处理;常用的处理方法之一为还原沉淀法生成Cr(OH)3而除去. (1)Cr2O72?和CrO42?之间存在相互转化:2CrO42?(黄色)+2H+?Cr2O72?(橙色)+H2O,能说明反应达平衡状态的是 . a.Cr2O72?和CrO42?的浓度相同 b.2v (Cr2O72?)=v (CrO42?) c.溶液的颜色不变 (2)常温下,Cr(OH)3的溶度积Ksp=1×10?32 , 要使c(Cr3+)降至1×10?5mol/L以下,溶液的pH应调至 以上. |
|
| 19. | 详细信息 |
|
根据下列化合物:①CH3COOH ②Na2C2O4③NaCl ④NaOH⑤NH4Cl.回答问题: (1)H2C2O4是弱酸,则②溶液中盐水解的离子方程式为 ; (2)浓度均为 0.1mol?L?1 的④、⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3?H2O)= ; (3)常温下,pH都为4的①、⑤溶液中水电离出的c(OH?)的比为 . |
|
| 20. | 详细信息 | ||||||||||||||||
|
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药品,其说明书部分内容摘录如下: 【规格】每片含琥珀酸亚铁0.1g 【适应症】用于缺铁性贫血症,预防及治疗用. 【贮藏】避光、密封、在干燥处保存. 【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大  该药品中Fe2+会缓慢氧化.国家规定该药物中Fe2+的氧化率(已经被氧化Fe2+的质量与Fe2+总质量的比值)超过10.00% 即不能再服用. (1)实验室可采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+进行滴定(假设药品中其他成份不与KMnO4反应).滴定过程发生如下反应,请补充完整: Fe2++ MnO4?+= Mn2++ + . (2)实验前,称量含铁元素质量分数为20.00%的“速力菲”20.0g,将其全部溶于稀H2SO4中,配制成250ml溶液,配制时图1下列仪器肯定不需要的是 . (填名称) (3)取配制好的溶液20.00ml于锥形瓶中,用0.1000mol/L?1的KMnO4溶液滴定,某同学设计了图2滴定方式(夹持部分略去),最合理的是 (填字母序号);若滴定过程中,锥形瓶中待测液飞溅出来,则测出的Fe2+的氧化率 (填偏高、偏低或不变). (4)三次操作读数如下:
计算该“速力菲”补铁药品Fe2+的氧化率为 %. |
|||||||||||||||||
| 21. | 详细信息 |
燃料电池是将化学能转化为电能的装置,能量利用率高,环境友好.是未来能源领域发展的方向.  (1)图1左为绿色电源“二甲醚【(CH3)2O】燃料电池”的工作原理示意图.电池工作时,电子流动方向是 极经外电路到 极((填a或b)),a电极上发生反应的电极反应式为 . (2)连接图2装置的电源为(1)问中的二甲醚燃料电池.接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深.则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连.通电时发生反应的总的离子反应方程式为: ;若将电极材料都改为石墨,电解质溶液改为MnSO4溶液可以制备MnO2;则阳极反应式为;如二甲醚消耗23克,则理论上产生MnO2的质量为 克. |
|
最近更新



