2017-2018年高二上学期阶段测试化学考试题(江苏省如东高级中学)
| 1. 选择题 | 详细信息 |
|
化学与社会、环境等密切相关,下列有关说法中不正确的是 A. 很多城市对废旧电池进行回收处理 B. 利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 C. 现在不少地区正在使用沼气、太阳能、风能等能源替代传统的煤炭 D. PM2.5含有的铅、镉、铬、钒、硼等元素均为对人体有害的金属元素 |
|
| 2. 选择题 | 详细信息 |
|
下列物质的使用不涉及化学变化的是 A. 液氨用作致冷剂 B. 把煤制成水煤气 C. 氢氟酸刻蚀玻璃 D. 明矾用作净水剂 |
|
| 3. | 详细信息 |
|
常温下,取铝土矿(含有A12O3、FeO、Fe2O3、SiO2等物质) 用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是 A. 加入过量NaOH 溶液: Na+、A1O2-、OH-、SO42- B. 加入过量氨水: NH4+、A13+、OH-、SO42- C. 通入过量SO2: Fe2+、H+、SO32-、SO42- D. 加入过量NaClO溶液: Fe2+、Na+、C1O-、SO42- |
|
| 4. 选择题 | 详细信息 |
|
下列化合物的俗称与化学式不对应的是 A. 熟石灰:CaO B. 纯碱:Na2CO3 C. 醋酸:CH3COOH D. 胆矾:CuSO4?5H2O |
|
| 5. 选择题 | 详细信息 |
|
“玉兔”号月球车用 A. 质子数是94 B. 质量数238 C. 中子数是94 D. |
|
| 6. 选择题 | 详细信息 |
|
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是 A. K B. Al C. Fe D. Na |
|
| 7. 选择题 | 详细信息 |
|
下列分离方法中,和物质的沸点有关的是 A. 分液 B. 萃取 C. 蒸馏 D. 过滤 |
|
| 8. 选择题 | 详细信息 |
|
下列各组中的两物质作用时,反应条件(温度、反应物用量比)改变,不会引起生成物改变的是 A. Na和O2 B. NaOH和CO2 C. Na2CO3和HCl D. NaHCO3和NaOH |
|
| 9. 选择题 | 详细信息 |
|
下列化合物中,含有极性共价键的离子化合物是 A. MgCl2 B. N2H4 C. NaCl D. NH4Cl |
|
| 10. 选择题 | 详细信息 |
|
下列实验能达到目的的是 A. 用可见光束照射以区别溶液和胶体 B. 将NH4Cl溶液蒸干制备NH4Cl固体 C. 用萃取分液的方法除去酒精中的水 D. 只滴加氨水鉴别NaCl、A1Cl3、MgCl2、Na2SO4四种溶液 |
|
| 11. 选择题 | 详细信息 |
|
在给定条件下,下列选项所示的物质间转化均能实现的是 A. MgCO3 B. NaCl(aq) C. Cu2(OH)2CO3 D. SO2 |
|
| 12. 选择题 | 详细信息 |
|
下列有关物质应用的说法正确的是 A. 铝罐可久盛食醋 B. 盐类都可用作调味品 C. 生石灰用作食品抗氧化剂 D. 小苏打是面包发酵粉的主要成分之一 |
|
| 13. 选择题 | 详细信息 |
|
下列实验操作及结论正确的是 A. 用洁净的铂丝蘸取某溶液于酒精灯外焰上灼烧,显黄色,证明该溶液中不含K+ B. 配制0.lmol?L-lNaCl溶液时,若缺少洗涤步骤,会使实验结果偏高 C. 萃取碘水中的碘时,可以选择苯作为萃取剂 D. 某无色溶液中滴加氯化钡产生白色沉淀,再加稀盐酸沉淀不消失,证明原溶液中含SO42- |
|
| 14. 选择题 | 详细信息 |
|
下列有关化学用语的表示正确的是 A. N2的电子式: C. CCl4 分子的比例模型:  D. 氰酸铵(NH4CNO) 与尿素[CO(NH2)2]互为同分异构体 D. 氰酸铵(NH4CNO) 与尿素[CO(NH2)2]互为同分异构体 |
|
| 15. 选择题 | 详细信息 |
|
2014年南京青奥会上发令枪所用“火药”的主要成分是氯酸钾和红磷,撞击时发生化学反应:5KClO3+6P=3P2O5+5KCl。下列有关该反应的叙述中,正确的是 A. 该反应中红磷是氧化剂 B. 该反应属于置换反应 C. 反应中消耗3 mol P时,转移电子的物质的量为15 mol D. 发令时产生的白烟全是KCl固体 |
|
| 16. 选择题 | 详细信息 |
|
能正确表示下列反应的离子方程式是 A. CuCl2溶液中加入少量氨水:Cu2++2OH-=Cu(OH)2↓ B. 铝溶于氢氧化钠溶液:2Al+2OH-+2H2O=2A1O2-+3H2↑ C. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ D. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
|
| 17. 选择题 | 详细信息 |
 A. 装置①:用于吸收HCl气体 B. 装置②:用于除去NO2中的NO C. 装置③:配制1mol/L NaCl溶液定容操作 D. 装置④:滴有淀粉碘化钾溶液的纸蝴蝶变蓝 |
|
| 18. 选择题 | 详细信息 |
|
下列过程需要吸收热量的是 A. Na与H2O反应 B. 铝与磁性氧化铁在高温下反应 C. 形成氨气中的N-H键 D. Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
|
| 19. 选择题 | 详细信息 |
|
当其他条件不变时,下列说法正确的是 A. 加水稀释能减慢双氧水分解的反应速率 B. 用块状锌代替粉末状锌与稀硫酸反应能加快反应速率 C. 当反应物与生成物浓度相等时,反应达到限度 D. 在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
|
| 20. 选择题 | 详细信息 |
锌-空气电池(原理如下图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是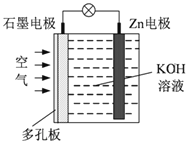 A. 氧气在石墨电极上发生氧化反应 B. 该电池的石墨电极是负极 C. 该电池放电时电子经氢氧化钾溶液向石墨电极移动 D. 该电池的负极反应为Zn-2e-+2OH-=ZnO+H2O |
|
| 21. 选择题 | 详细信息 |
|
下列有机化学方程式书写正确的是 A. CH4+Cl2 B. C. H2C=CH2+Br2 D. CH3CH2OH+CH3COOH |
|
| 22. 选择题 | 详细信息 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中不正确的是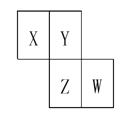 A. 离子半径:Z>X>Y B. 最高价氧化物对应水化物的酸性:Z>W>X C. Y、Z位于元素周期表中第ⅥA族,但最高正价不相同 D. X、W的气态氢化物混合产生白烟 |
|
| 23. 选择题 | 详细信息 |
|
硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是 A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2 C. 原混合气体中NO在标准状况下的体积可能为16. 8 L D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应 |
|
| 24. 填空题 | 详细信息 | ||||||||||||
|
《化学与生活》(1)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题: ① 我国发射的“神州”系列飞船上使用了一种由我国科学家合成的新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是_____填字母)。 a.它耐高温抗氧化 b.它比钢铁轻、硬,但质地较脆 c.它是一种新型无机非金属材料 ②工业制备下列物质时,不需要石灰石的是___________(填字母)。 a.玻璃 b.水泥 c.陶瓷 ③材料与化学密切相关,表中对应关系正确的是_____(填字母)。
|
|||||||||||||
| 25. 推断题 | 详细信息 |
已知A?L所代表的物质(溶液中的溶质),除F外其余均是中学化学里常见的物质,它们的转化关系如图所示(反应中部分产物及水已略去)。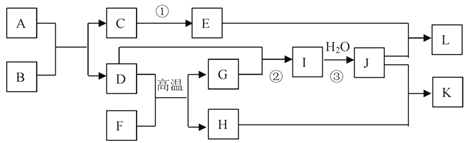 已知:a.通常状况下,A是淡黄色固体,B 是无色无味气体,D 是气体单质,H 是红棕色固体,L是白色胶状沉淀;b.反应①是工业生产普通玻璃的反应之一,反应②③是工业生产J的部分反应;c. F是由两种元素组成的化合物,其质量比为7:8;请填写下列空白: (1)A的电子式__________。 (2)K的化学式_____________。 (3)完成下列反应方程式: ①D+G→I的化学方程式:_____________。 ②E+J→L的离子方程式:________________。 |
|
| 26. 综合题 | 详细信息 |
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2 等)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)可用于合成三盐基硫酸铅(组成可表示为3PbO?PbSO4?H2O),其工艺流程如下: (1)铅膏中加入Na2SO3溶液所发生的离子方程式_____________。 (2)操作I的名称__________。用18.4 mol ? L-1H2SO4 配制100 mL1 mol ? L-1H2SO4溶液需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、__________。 (3)滤液A能用来回收Na2SO4?10H2O,提取该晶体的主要步骤有蒸发浓缩、______、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是__________。 (4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重2.0% ( 列式计算x值_________和m:n值__________。 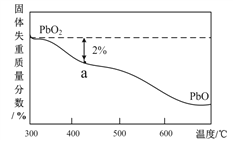 |
|




